УРОВЕНЬ В. <TITLE>Пример 2</TITLE>
< HTML> < HEAD> < TITLE> Пример 2< /TITLE> < /HEAD> < H1> Простейшая таблица < /H1> < TABLE BORDER=1> < CAPTION> <! --Это заголовок таблицы--> У таблицы может быть заголовок < /CAPTION> < TR> < TD> Первая строка, первая колонка < /TD> < TD> Первая строка, вторая колонка < /TD> < /TR> < TR> < TD> Вторая строка, первая колонка < /TD> < TD> Вторая строка, вторая колонка < /TD> < /TR> < /TABLE> < /BODY> < /HTML> Упражнение 6: Создайте в своей папке HTML- документ, содержащий таблицу с объединенными и разделенными ячейками. Наберите текст программы, сохраните как Задание 6.html. Изучите теги Colspan, Rowspan. < HTML> < HEAD> < TITLE> Пример объединения ячеек с помощью COLSPAN и ROWSPAN< /TITLE> < /HEAD> < BODY BGCOLOR = BLUE TEXT = BLACK > < TABLE ALIGN= “CENTER” BORDER= “2” LEFTMARGIN= “40” RIGHTMARGIN= “40” CELLPACING= “0” CELLPADDING= “40” WIDTH= “100%” HEIGHT= “200”> < TR ALIGN= “CENTER” BGCOLOR=GRAY> < TH COLSPAN= “2”> Ячейка1 < /TH> < /TR> < TR> < TD ALIGN= “CENTER” ROWSPAN= “3”> Ячейка 2 < /TD> < TD ALIGN= “CENTER” > Ячейка 3 < /TD> < /TR> < TR> < TD ALIGN= “CENTER” > Ячейка 4 < /TD> < /TR> < TR> < TD ALIGN= “CENTER” > Ячейка 5 < /TD> < /TR> < /TABLE> < /BODY> < /HTML>
Задания для самостоятельной работы:
Примечание: Документ должен содержать все представленные выше теги создания объектов.
Контрольные вопросы:
СПИСОК ЛИТЕРАТУРЫ
1. Гарнаев А.Ю. Использование MS Excel, VBA в экономике и финансах. – СПб.: БХВ – Санкт-Петербург, 2004. 2. Макарова Н.В. Информатика. – М.: Финансы и статистика, 2004. 3. Хомоненко А., Гридин В. Microsoft Access. Быстрый старт. – Санкт-Петербург: БХВ – Петербург, 2002. 4. Информатика. Базовый курс/ С. В. Симонович и др. – СПб: Издательство «Питер», 2000.-640 с.: ил. 5. Леонтьев В. Новейшая энциклопедия персонального компьютера. – М.: ОЛМА – ПРЕСС, 1999.-640 с. 6. С. К. Каратыгин, А. Ф. Тихонов и др. Электронный офис: В 2-х томах: Т. 1. – М.: «Нолидж», 1999.-768 с. ил. 7. Буза М. К. и др. Операционная среда Windows и ее приложения. – Мн.: Выш. Шк., 1997. – 336 с 8. Б.Курицкий. Поиск оптимальных решений средствами Excel 7.0. –СПб., 1997. 9. Ф. Новиков, А. Яценко. Microsoft Office 97 в целом. –М., 1998. 10. В. Долженков, Ю. Колесников, В. Рычков. Практическая работа с MS Excel 97, М 1998 11. В. Пасько. Access 2000 русифицированная версия. Киев, 2001 12. В. Пасько. Word 7.0 русифицированный для Windows 95. Киев 1996 13. К. Айвенс. Эксплуатация Windows NT. Проблемы и решения. М 1996 14. П. Нортон. Разработка приложений в Access 97. –Киев, 1998. 15. Н. Николь, Р. Альбрехт. Excel 5.0 для профессионалов. –М.: ЭКОМ. 1995 16. Симонович С. В., Евсеев Г. А., Алексеев А. Г. Специальная информатика: Учебное пособие. – М.: АСТ _ ПРЕСС: Информ – Пресс, 1998.- 480 с. 17. Фигурнов В. Э. IBM PC для пользователя. Краткий курс. – М.: ИНФРА _ М, 1997. – 480 с. ил. СОДЕРЖАНИЕ
Лабораторная работа № 1: Операционная система Windows. Основные объекты и приемы управления Windows. Программа Проводник.............................................................................................................................................................................................. 3 Лабораторная работа № 2: Обслуживание дисков. Архивация файлов. Антивирусные программы...................... 5 Лабораторная работа № 3: Текстовый процессор Word. Создание, редактирование и форматирование документов....................................................7 Лабораторная работа № 4: Текстовый процессор Word. Вставка рисунков, создание графических объектов.. 11 Лабораторная работа № 5: Текстовый процессор Word. Редактор формул. Создание и форматирование таблиц. Вычисления в таблице................................................................................................................................................................................................. 14 Лабораторная работа № 6: Текстовый процессор Word. Создание макросов.............................................................. 17 Лабораторная работа № 7: Табличный процессор MS Excel. Ввод и редактирование данных. Адресация ячеек 19 Лабораторная работа № 8: Вычисление значений функции. Мастер функции. Построение графиков и диаграмм 23 Лабораторная работа №9: Логические функции. Построение графиков функции с двумя и тремя условиями.. 26 Лабораторная работа № 10: Построение поверхности. Решение уравнений методом подбора параметров.... 29 Лабораторная работа № 11: Сортировка и фильтрация данных.................................................................................... 31 Лабораторная работа № 12: Матрицы и матричные формулы........................................................................................ 33 Лабораторная работа № 13: Табличный процессор Excel. Массивы. Вычисление сложных выражений. Метод Крамера 35 Лабораторная работа № 14: Поиск решения и решение оптимизационных задач. Линейная оптимизационная задача. 38 Лабораторная работа № 15: Функции Microsoft Excel для расчета операций по кредитам и займам.................. 40 Лабораторная работа № 16: Расчет периодических платежей. Вычисление амортизации..................................... 40 Лабораторная работа № 17: Сводные таблицы. Консолидация данных....................................................................... 40 Лабораторная работа № 18: Система управления базами данных Microsoft Access. Создание базы данных из нескольких таблиц................................................................................................................................................................................................................ 40 Лабораторная работа № 19: Создание форм.......................................................................................................................... 40 Лабораторная работа № 20: Создание запросов.................................................................................................................. 40 Лабораторная работа № 21: Создание отчетов..................................................................................................................... 40 Лабораторная работа № 22: Язык создания гипертекстовых документов – HTML. Теги форматирования текста. Вставка рисунков, создание гиперссылки. Списки. Таблицы............................................................................................................... 40 СПИСОК ЛИТЕРАТУРЫ........................................................................................88
УРОВЕНЬ В 1. Определить количество моль воды в формуле кристаллогидрата Na2CO3·nH2O, если в результате прокаливания его масса изменилась от 1, 43 до 0, 53 г. Определить объем выделившейся парообразной воды при 200оС и давлении 98, 2 кПа.
Расчет n ведем по уравнению реакции (1.1)
где
n = Формула кристаллогидрата Na2CO3·10H2O Рассчитываем объем выделившейся газообразной воды при Т = 273 + 200 = 473 К и Р = 98, 2 кПа по уравнению Менделеева-Клапейрона
где Р – Па, V – м3, m – кг, М Т – К. Откуда Ответ: формула кристаллогидрата: Na2CO3· 10Н2О; 2. Определить состав смеси (% масс.), содержащей карбонат магния (15 г) и оксид магния. Если после прокаливания смеси, полученный продукт вступил в реакцию с ортофосфорной кислотой и образовалось 80 г ортофосфата магния. Составить уравнения реакций.
При прокаливании смеси протекает реакция MgCO3 Тогда по этому уравнению М m где М
После прокаливания смесь состоит только из MgО
При взаимодействии продукта, полученного после прокаливания с ортофосфорной кислотой, протекает реакция 3MgO(общ.) + 2H3PO4 = Mg3(PO4)2 + 3H2O 3МMgО ________ М
тогда
где М откуда mMgO(общ) = тогда mMgO(исх) = mMgO(общ) – mMgO (из MgCO Таким образом mсмеси = mMgO(исх) + Состав исходной смеси ω ω 3. При взаимодействии 1, 8 г технического карбоната кальция (мела) с HCl выделилось 400 см3 CO2, собранного над водным раствором NaHCO3 и измеренного при температуре 288 К и давлении 730 мм рт.ст. Давление паров воды при 288 К равно 12, 79 мм рт.ст. Определить содержание СаСО3 в техническом карбонате кальция в процентах.
СаСО3 +2HCl=CaCl2 + H2O+CO2↑ (1.4)
Находим
где откуда где
где
Тo = 273 К, Рo = 760 мм рт. ст., тогда Определяем массу чистого СаСО3 по формуле (1.5):
Ответ: содержание СаСО3 в меле 88, 89%.
2. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
УРОВЕНЬ В 1. При растворении 16, 25 г двухвалентного металла в кислоте выделилось 6, 52 л водорода, собранного над водой и измеренного при температуре 298К и давлении 730 мм рт. ст. Определить молярную массу эквивалента металла и назвать металл. Давление паров воды при температуре 298К равно 23, 76 мм рт. ст.
По объединенному уравнению газового состояния
где: То = 273 К, Ро = 760 мм рт.ст. Робщ =
определяем
Мэк(Ме) = Мэк(Ме) = ММе = Мэк(Ме) ∙ В = 32, 79 ∙ 2 = 65, 58 г/моль, что соответствует молекулярной массе атома цинка. Ответ: Мэк(Zn) = 32, 79 г/моль, металл – Zn
2. При окислении металла израсходовано 3, 79 л кислорода, измеренного при 293 К и давлении 740 мм рт.ст. Образовалось 39, 43 г оксида. Определить молярные массы эквивалентов металла и оксида. Назвать металл.
По объединенному уравнению газового состояния
где: ТО = 273 К, РО = 760 мм рт.ст. определяем
Мэк(Окс) = Мэк(Окс) = Мэк(Ме) + Мэк(О) Мэк(Ме) = Мэк(Окс) - Мэк(О) Мэк(Ме) = 64, 2 – 8 = 56, 2 г/моль ММе = Мэк(Ме) ∙ В. Если В = 1, то МЭ = 56, 2 г/моль. Такого металла в таблице Д.И. Менделеева нет. Если В = 2, то ММе = 112, 4 г/моль. Следовательно, металл - кадмий Ответ: Мэк(Окс) = 64, 2 г/моль Мэк(Ме) = 56, 2 г/моль Ме – Cd 3. Написать уравнения реакций взаимодействия гидроксида железа (III) с хлороводородной кислотой с образованием: В каждой реакции вычислить молярную массу эквивалента гидроксида железа (III). В одной из реакций определить массу гидроксида железа (III), необходимую для взаимодействия с 3, 65 г хлороводородной кислоты.
а) HCl + Fe(OH)3 = Fe(OH)2Cl + H2O
б) 2HCl + Fe(OH)3 = FeOHCl2 + 2H2O Mэк[Fe(OH)3] = в) 3HCl + Fe(OH)3 = FeCl3 + 3H2O Mэк[Fe(OH)3] = По закону эквивалентов:
Откуда по реакции (в)
где Mэк[Fe(OH)3] = 35, 6 г, моль Ответ: а)Mэк[Fe(OH)3] = 106, 8 г/моль б) Mэк[Fe(OH)3] = 53, 4 г/моль в) Mэк[Fe(OH)3] = 35, 6 г/моль.
|


 Na2CO3 +nH2O↑ (1.1)
Находим массу воды (
Na2CO3 +nH2O↑ (1.1)
Находим массу воды (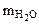 ), выделившейся при разложении кристаллогидрата:
), выделившейся при разложении кристаллогидрата:
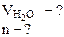
 = 1, 43 - 0, 53 = 0, 9 г
= 1, 43 - 0, 53 = 0, 9 г -
-  106 г/моль - n18 г/моль
106 г/моль - n18 г/моль -
-  0, 53 г - 0, 9 г
0, 53 г - 0, 9 г

 =
= 
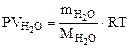
 – кг/моль, R – 8, 314 Дж/моль·К,
– кг/моль, R – 8, 314 Дж/моль·К,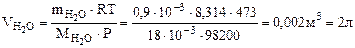

 = 15 г
m
= 15 г
m  = 80 г
= 80 г

 +
+ 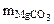
 мас.
мас.
 мас.
мас.
 -? ω
-? ω  MgO + CO2
MgO + CO2 84, 3 г/моль - 40, 3 г /моль
84, 3 г/моль - 40, 3 г /моль (из MgCO3) 15 г -
(из MgCO3) 15 г -  =
=  = 7, 17 г
= 7, 17 г
 mMgO(общ) 80 г
mMgO(общ) 80 г 3∙ 40, 3г/моль 262, 9 г/моль
3∙ 40, 3г/моль 262, 9 г/моль mMgO(общ) 80 г
mMgO(общ) 80 г = 40, 3 г/моль, М
= 40, 3 г/моль, М  = 262, 9 г/моль
= 262, 9 г/моль г
г ) = 36, 79 г – 7, 17 г = 29, 62 г
) = 36, 79 г – 7, 17 г = 29, 62 г мас.
мас.


 Так как, примеси, содержащиеся в техническом СаСО3 не взаимодействуют с HCl с образованием CO2, то массу чистого карбоната кальция (
Так как, примеси, содержащиеся в техническом СаСО3 не взаимодействуют с HCl с образованием CO2, то массу чистого карбоната кальция (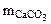 )
определяем по уравнению реакции (1.4):
)
определяем по уравнению реакции (1.4):

 22400 cм3 (н.у.)
22400 cм3 (н.у.)




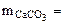
 (1.5)
(1.5) Для определения
Для определения 
 - парциальное давление СО2, так как СО2 собран над водным раствором NaHCO3, то
- парциальное давление СО2, так как СО2 собран над водным раствором NaHCO3, то =
= 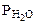 , тогда
, тогда мм рт.ст.
мм рт.ст. 
 =
= 
 , тогда
, тогда
 =16, 25 г
В = 2
=16, 25 г
В = 2
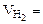 6, 52 л
Т = 298 К
Робщ = 730 мм рт.ст
6, 52 л
Т = 298 К
Робщ = 730 мм рт.ст
 = 23, 76 мм рт.ст
Мэк(Ме) -?
Ме -?
= 23, 76 мм рт.ст
Мэк(Ме) -?
Ме -?

 =
= 
 Мэк(Ме) =
Мэк(Ме) =  =
=
 = 11, 2 л/моль
= 11, 2 л/моль

 +
+ 
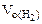

 = 5, 55 л
= 5, 55 л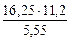 =32, 79 г/моль
=32, 79 г/моль , г/моль, где В – валентность металла
, г/моль, где В – валентность металла 3, 79 л
Т = 293 К
3, 79 л
Т = 293 К
 = 740 мм рт.ст.
Мэк(Окс) -?
Мэк(Ме) -?
Ме -?
= 740 мм рт.ст.
Мэк(Окс) -?
Мэк(Ме) -?
Ме -?


 Мэк(Окс) =
Мэк(Окс) = 
 л/моль
л/моль


 = 3, 44 л.
= 3, 44 л. 64, 2 г/моль
64, 2 г/моль
 = 3, 65 г
Fe(OH)3
Mэк[Fe(OH)3] -?
= 3, 65 г
Fe(OH)3
Mэк[Fe(OH)3] -?

 , г/моль
, г/моль
 - число гидроксогрупп,
замещенных в данной реакции на кислотный остаток.
По реакциям а), б) и в):
Определяем
- число гидроксогрупп,
замещенных в данной реакции на кислотный остаток.
По реакциям а), б) и в):
Определяем 
 = 106, 8 г/моль
= 106, 8 г/моль 53, 4 г/моль
53, 4 г/моль 35, 6 г/моль.
35, 6 г/моль.
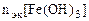 , т.е.
, т.е. 
 г,
г, г.
г. 3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
3. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА


