УРОВЕНЬ В. Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный)
Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2А. Температура 298К, давление 99 кПа.
где F = 96500 Кл/моль, если τ – cек, F = 26, 8 А∙ ч/моль, если τ – час.
где Объем водорода при заданных условиях отличных от нормальных определяем из уравнения:
откуда: Объем кислорода при заданных условиях:
Ответ: 3, 73 л водорода, 1, 865 л кислорода.
2.Металлическую деталь, площадь поверхности которой равна 100 см2, необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длиться осаждение при силе тока 8А и выходе по току 98%, если толщина покрытия 0, 15 мм. Плотность меди – 8, 9 г/см3.
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде равна: mCu(факт) = Масса меди, необходимая для получения медного покрытия: mCu(факт) = S∙ h∙ ρ (г), где S – см2, h – см, ρ – г/см3. S∙ h∙ ρ Cu = откуда где Mэк(Cu) = F = 26, 8 – А∙ ч/моль, 10-1 – коэффициент пересчета мм в см. Ответ: 1, 43 часа.
3. Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см3 этого раствора потребовалось пропустить ток силой 4А в течение 25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100%.
По закону эквивалентов: nэк(AgNO3) = nэк(Ag), nэк(Ag) = где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току. mAg =
Молярная концентрация эквивалента раствора AgNO3:
60 – коэффициент пересчета мин. в сек. 10-3 – коэффициент пересчета см3 в л. Ответ:
|

 1. Схема электролиза-?
2.
1. Схема электролиза-?
2.  (катод) -?
3.
(катод) -?
3.  (анод) -?
(анод) -?
 Схема электролиза:
K(-) A(+) (инертный)
K+
Схема электролиза:
K(-) A(+) (инертный)
K+  2H2O + 2ē = 2H2O - 4ē =
= H2 + 2OH- = О2 + 4H+
На катоде выделяется H2, на аноде выделяется О2
По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.):
2H2O + 2ē = 2H2O - 4ē =
= H2 + 2OH- = О2 + 4H+
На катоде выделяется H2, на аноде выделяется О2
По закону Фарадея объемы водорода и кислорода, выделившиеся при (н.у.):
 =
=  = 3, 34 л.
= 3, 34 л.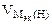 = 11, 2 л/моль.
= 11, 2 л/моль. =
=  = 1, 67 л,
= 1, 67 л, = 5, 6 л/моль, т.е.
= 5, 6 л/моль, т.е.  ,
, =
=  = 3, 73 л
= 3, 73 л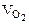 = 1/2
= 1/2 
 Дано:
Электролит:
CuCl2
S = 100 см2
h = 0, 15 мм
I = 8 A
BT = 98 %
ρ Cu = 8, 9 г/см3
Дано:
Электролит:
CuCl2
S = 100 см2
h = 0, 15 мм
I = 8 A
BT = 98 %
ρ Cu = 8, 9 г/см3
 Анод медный
Схема электролиза-?
Анод медный
Схема электролиза-?
 Время электролиза, τ -?
Время электролиза, τ -?
 РЕШЕНИЕ
CuCl2 = Cu2+ + 2Cl-
Схема электролиза:
K(-) A(+) (Cu)
Cu2+ + 2ē = Cu Cl-
H2O H2O
Cu – 2ē = Cu2+
На катоде выделяется Cu, на аноде растворяется Cu.
ВТ=
РЕШЕНИЕ
CuCl2 = Cu2+ + 2Cl-
Схема электролиза:
K(-) A(+) (Cu)
Cu2+ + 2ē = Cu Cl-
H2O H2O
Cu – 2ē = Cu2+
На катоде выделяется Cu, на аноде растворяется Cu.
ВТ=  ; mCu(факт) =mCu(теор)·ВТ
; mCu(факт) =mCu(теор)·ВТ
 .
. 1, 43 часа,
1, 43 часа, = 32 г/моль
= 32 г/моль
 Дано:
Электролит: AgNO3
I = 4 A
Дано:
Электролит: AgNO3
I = 4 A
 = 75 см3
τ = 25 мин
Анод инертный
= 75 см3
τ = 25 мин
Анод инертный
 Схема электролиза-?
Схема электролиза-?
 -?
-?
 РЕШЕНИЕ
AgNO3 = Ag+ +
РЕШЕНИЕ
AgNO3 = Ag+ +  Схема электролиза:
K(-) A(+) инертный
Ag+ + ē = Ag
Схема электролиза:
K(-) A(+) инертный
Ag+ + ē = Ag  Молярная концентрация эквивалента раствора AgNO3:
Молярная концентрация эквивалента раствора AgNO3:
 ,
, , откуда
, откуда = nэк(Ag) = nэк(AgNO3)
= nэк(Ag) = nэк(AgNO3) = 0, 83 моль/л.
= 0, 83 моль/л.


