Лабораторная работа № 1.3
Анализ аммофоса на содержание основных компонентов
Цель работы – используя метод кислотно-основного кондуктометрического титрования, определить в минеральном удобрении аммофосе массовую долю (%): § основных компонентов – дигидрофосфата аммония NH4H2PO4 и гидрофосфата аммония (NH4)2HPO4; § питательных элементов – азота N и фосфора в виде Р2О5. Сущность работы. Основными компонентами аммофоса являются NH4H2PO4 и (NH4)2HPO4. Обе соли хорошо растворимы в воде и являются сильными электролитами: NH4H2PO4 → NH4+ + (NH4)2HPO4 → 2NH4+ + Таким образом, в растворе содержатся три вида ионов, способных к кислотно-основным взаимодействиям. Ион NH4+ является очень слабой кислотой с р Kа = 9, 25, а ионы
NH4+ + Na+ + OH– = NH4ОН + Na+, (1.3)
При этом изломы можно получить только для реакций (1.2) и (1.3), поскольку р Kа ( При титровании дигидрофосфат-ионов (l0 = 36) в растворе появляются более подвижные гидрофосфат-ионы (l0 = 57) и ионы Na+ (l = 52), поэтому электропроводность раствора возрастает. Далее по мере протекания реакции (1.3) электропроводность раствора снижается за счет замены более подвижных ионов NH4+ (l0 = 76) менее подвижными ионами Na+ (l0 = 52). После того, как будут полностью оттитрованы NH4+-ионы, электропроводность резко возрастает за счет избытка ионов Na+ (l0 = 52) и OH– (l0 = 205). Таким образом, на кривой титрования наблюдается два излома. Объем титранта, пошедший на титрование до момента достижения первого излома (V 1), позволяет рассчитать содержание NH4H2PO4, а по разнице в объемах, затраченных на достижение второго (V 2) и первого (V 1) изломов, можно рассчитать содержание (NH4)2HPO4. Оборудование, посуда, реактивы: кондуктометр с измерительным датчиком; магнитная мешалка со стержнем; технические и аналитические весы; бюретка; бюкс для взвешивания; мерная колба вместимостью 50, 0 или 100, 0 мл; воронка; пипетка Мора вместимостью 10, 0 мл; стакан вместимостью 150–200 мл; аммофос; стандартный 0, 1 н. раствор NaOH. Выполнение работы. Получают аммофос, рассчитывают его навеску, необходимую для приготовления заданного объема раствора с концентрацией ~ 0, 1 н. Для расчета используют молярную массу основного компонента – NH4H2PO4. Берут навеску на аналитических весах, растворяют в мерной колбе. Аликвоту приготовленного раствора титруют раствором щелочи, прибавляя его по 0, 2–0, 5 мл, до получения двух изломов. Титрование продолжают, пока не будет получено несколько точек после второго излома. По полученным данным строят кривую титрования в координатах χ = f (V) и графически находят объемы титранта, пошедшие на титрование до первой (V 1) и второй (V 2) точек эквивалентности. Расчет результатов анализа. Зная точную концентрацию щелочи и ее объем V 1, а также объем аликвоты титруемого раствора, рассчитывают молярную концентрацию эквивалента соли NH4H2PO4 в растворе, а затем массу этой соли в мерной колбе и навеске. Зная массу NH4H2PO4 и массу навески, вычисляют массовую долю NH4H2PO4 в аммофосе. Рассчитывают величину D V = V 2 – V 1. Этот объем титранта пошел на титрование суммарного количества NH4+ из двух солей. На титрование иона NH4+ из соли NH4H2PO4 пошло столько же щелочи, сколько на титрование иона По полученным данным рассчитывают массовые доли (%) питательных элементов – азота N и фосфора в виде Р2О5.
|

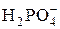 ,
, .
.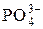 + Na+ + Н2О. (1.4)
+ Na+ + Н2О. (1.4)


