Определение содержания HCl и H3BO3 в смеси с использованием двух методов анализа
Цели работы: 1) определить массу HCl и H3BO3 (г) в выданной для анализа пробе, используя метод кислотно-основного кондуктометрического титрования; 2) определить массу HCl и H3BO3 (г) в выданной для анализа пробе, используя метод кислотно-основного потенциометрического (рН-метрического) титрования; 3) сопоставить данные анализа, полученные двумя независимыми методами, с истинным значением, рассчитать относительные погрешности определения в каждом случае и сделать выводы о сравнительной точности предложенных методик анализа. Сущность работы. Кислотно-основные реакции широко применяются как в кондуктометрическом, так и в рН-метрическом титровании, на чем и основано дифференцированное определение сильной и слабой кислот в смеси. При титровании смеси сильной кислоты HCl и слабой H3BO3 (pK1 = 9, 15; pK2 = 12, 74; pK3 = 13, 80) стандартным раствором щелочи сначала будет оттитровываться HCl: HCl + NaOH = NaCl + H2O, а затем – слабая борная кислота. При рН-метрическом титровании невозможно получить скачок на кривой титрования, если р Kа > 8. Следовательно, борная кислота должна титроваться без скачка, что делает невозможным ее определение. Однако H3BO3 может образовывать более сильные комплексные кислоты с рядом многоатомных спиртов (этиленгликоль, глицерин, маннит и др.). Поэтому после получения скачка, соответствующего оттитровыванию HCl, в раствор вводят многоатомный спирт и продолжают титрование до получения второго скачка. При этом в растворе протекает реакция (на примере этиленгликоля):
СН2 – ОН ОН НО – СН2
СН2 – О О – СН2
Образовавшаяся комплексная кислота Н[В(С2Н4О2)2] имеет р Kа = 4, 48, поэтому при титровании ее раствором щелочи: Н[В(С2Н4О2)2] + NaOH = Na[В(С2Н4О2)2] + H2O получается явно выраженный скачок на кривой титрования. При таком титровании f экв(H3BO3) = 1, так как 1 моль H3BO3 в реакции (1.1) соответствует 1 моль одноосновной комплексной кислоты Н[В(С2Н4О2)2]. При кондуктометрическом титровании излом на кривой титрования слабой кислоты можно получить даже при р Kа = 10, что позволяет оттитровать H3BO3 по первой ступени в отсутствие многоатомных спиртов. Кривая титрования смеси HCl и H3BO3 имеет 2 излома, соответствующих последовательному протеканию реакций: H+ + Cl– + Na+ + OH– = Na+ + Cl– + Н2О, H3BO3 + Na+ + OH– = ВO2– + Na+ + 2Н2О. При титровании HCl наблюдается резкое уменьшение электропроводности раствора, так как очень подвижные ионы Н+ (l0 = 362) заменяются менее подвижными ионами Na+ (l0 = 52). При титровании слабой борной кислоты происходит увеличение числа ионов в растворе за счет образования сильного электролита – соли NaBO2 (метабората натрия), поэтому кривая пойдет вверх. После достижения второй т. э. за счет введения избытка титранта NaOH кривая пойдет вверх более круто, так как в растворе появятся ионы ОН– с высокой подвижностью (l0 = 205). Оборудование, посуда, реактивы: кондуктометр с измерительным датчиком; магнитная мешалка со стержнем; бюретка; рН-метр или иономер со стеклянным и хлоридсеребряным электродами; 2 стакана вместимостью 150–200 мл; стандартный 0, 1 н. раствор NaOH; маннит или глицерин. Выполнение работы. Получить 2 одинаковые пробы анализируемого раствора в 2 стакана вместимостью 150–200 мл. Для проведения кондуктометрического титрования пробу разбавить дистиллированной водой и титровать стандартным раствором щелочи, добавляя его порциями по 0, 2–0, 5 мл и измеряя удельную электропроводность раствора после добавления каждой порции титранта. По полученным данным построить кривую титрования, определить объемы титранта, затраченные на достижение обеих т. э., и рассчитать массы кислот в смеси (г) по закону эквивалентов. Для проведения рН-метрического титрования пробу разбавить дистиллированной водой и титровать стандартным раствором щелочи, добавляя его порциями по 0, 2–0, 5 мл и измеряя значение рН раствора после добавления каждой порции титранта. После достижения первого скачка прибавить ~ 1 г маннита или ~ 10 мл глицерина и продолжать титрование до получения второго скачка. По полученным данным построить интегральную (рН – V, мл) и дифференциальную (DрН / D V – V, мл) кривые титрования, определить по ним объемы титранта, затраченные на достижение обеих т. э., и рассчитать массы кислот в смеси (г) по закону эквивалентов. Рассчитать относительные погрешности определения по данным кондуктометрического и рН-метрического титрования, сделать выводы о сравнительной точности предложенных методик анализа.
|


 СН2 – ОН НО ОН НО – СН2
СН2 – ОН НО ОН НО – СН2 | + В + | →
| + В + | →

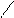 СН2 – О О – СН2 –
СН2 – О О – СН2 –




