Определение нитратов с использованием нитрат-селективного электрода
Цель работы – определить основные электрохимические характеристики нитрат-селективного электрода, на основании чего сделать вывод о пригодности электрода для проведения анализа с требуемой точностью; определить массу § Вариант 1 – метод градуировочного графика; § Вариант 2 – метод однократной добавки. Сущность работы. Определение содержания нитратов часто необходимо при анализе различных технологических объектов и объектов окружающей среды, так как избыточное содержание нитратов в почве и воде оказывает вредное воздействие на живые организмы. Как правило, определение нитратов в технических объектах является сложной аналитической задачей, на выполнение которой затрачивается большое количество времени. Применение ионоселективных электродов (ИСЭ) позволяет быстро решить поставленную задачу. Определение основано на измерении ЭДС элемента, составленного из индикаторного нитрат-селективного электрода и хлоридсеребряного электрода сравнения. Потенциал нитрат-селективного электрода зависит от концентрации нитратов в растворе:
При работе с любым ИСЭ необходима его предварительная калибровка – установление зависимости между потенциалом электрода и активностью (a) или концентрацией (C) определяемых ионов. Для построения градуировочного графика в координатах Е – р a (Е – р С) используют стандартные растворы. Наиболее часто применяют метод постоянной ионной силы. При этом используют растворы потенциалопределяющего компонента, содержащие избыток индифферентного электролита, что создает постоянную ионную силу как в стандартных, так и в анализируемых растворах. В этом случае можно использовать графическую зависимость Е – р С. Основными электрохимическими характеристиками любого ИСЭ являются интервал выполнения электродной функции, крутизна электродной функции, предел определения потенциалопределяющего иона, коэффициент селективности и время отклика ИСЭ. Первые четыре из них определяются по данным калибровки ИСЭ. Интервал выполнения (Нернстовская область) электродной функции – это интервал прямолинейной зависимости потенциала электрода от отрицательного логарифма концентрации (активности) иона. Он ограничен верхним (максимальная концентрация) и нижним (минимальная концентрация) пределами определения. Например, для нитрат-селективного электрода, согласно паспортным данным, этот диапазон должен составлять 0, 35–4, 0 pNO3. Крутизна (наклон) электродной функции – это угловой коэффициент наклона градуировочного графика, построенного в координатах Е – р а (Е – р С). Он определяет чувствительность электрода и численно равен предлогарифмическому множителю в уравнении Нернста. Таким образом, для однозарядных ионов эта величина должна составлять 58 мВ. Величина наклона характеризует качество электрода. Обычно, если она отличается от теоретической не более чем на 10–20%, и устойчиво воспроизводится, электрод можно использовать в анализе. Например, нитрат-селективный электрод считается годным, если наклон линейного участка составляет 50–70 мВ/pNO3. Предел определения потенциалопределяющего иона (С min) – это минимальная концентрация иона, определяемая с помощью данного ИСЭ. Для определения С min чаще всего экстраполируют линейные участки зависимости Е – р а (Е – р С). Полученная точка пересечения соответствует на оси абсцисс величине –lg С min. При очень низких концентрациях электрод утрачивает электродную функцию. Для нитрат-селективного электрода предел определения должен быть не выше чем 10–4 моль/л. Коэффициент селективности (k А/В) показывает возможность работы электрода в присутствии мешающих ионов и отражает влияние посторонних ионов В на потенциал электрода, селективного к ионам А. Чем меньше величина k А/В, тем выше селективность электрода. Коэффициент селективности определяют, используя метод смешанных растворов с постоянной активностью мешающего иона либо определяемого иона. Для расчета коэффициента селективности нитрат-селективного электрода по методу смешанных растворов с постоянной активностью мешающего иона (сульфата) по отношению к основному (
где С min( Нитрат-селективный электрод считается годным, если значение его коэффициента селективности по отношению к ионам Оборудование, посуда, реактивы: рН-метр или иономер; индикаторный электрод – нитрат-селективный; электрод сравнения – хлоридсеребряный; магнитная мешалка со стержнем; мерные колбы (50, 0 мл); мерная пипетка (5, 00 мл); стаканы (50 мл); стандартный 0, 1000 М раствор KNO3; фоновый 0, 1–1, 0 М раствор Na2SO4. При выполнении варианта 2 дополнительно: пипетка Мора (20, 00 мл). Выполнение работы 1. Определение характеристик ионоселективного электрода. Методом последовательного разбавления готовят стандартные растворы KNО3 с концентрациями 5 · 10–2, 1 · 10–2, 1 · 10–3, 1 · 10–4, 5 · 10–5, Измерение ЭДС проводят последовательно, переходя от растворов с меньшими концентрациями к растворам с большими концентрациями, всякий раз протирая электроды фильтровальной бумагой. Строят график в координатах Е, мВ – рNO3. По нему находят область прямолинейной зависимости ЭДС электродной системы от величины рNO3 – интервал выполнения электродной функции. Линейную область обрабатывают методом наименьших квадратов, желательно с применением ПК. По точке излома находят практическую величину предела определения. Сравнивают эти величины с паспортными данными. Определяют угловой коэффициент наклона градуировочного графика Δ Е / Δ рNO3 (изменение потенциала при изменении концентрации Рассчитывают величину потенциометрического коэффициента селективности нитрат-селективного электрода по отношению к сульфат-ионам и сравнивают ее с табличной. Если рассчитанное значение коэффициента селективности значительно превышает табличное, то электрод недостаточно селективен в присутствии ионов На основании определения основных электрохимических характеристик электрода делают обоснованный вывод о пригодности его для проведения анализа с требуемой точностью. 2. Количественное определение нитратов с помощью нитрат-селективного электрода. Получают анализируемый раствор в такую же мерную колбу, которая использовалась для приготовления стандартных растворов с целью калибровки электродов (50, 0 мл). Разбавляют его до метки тем же фоновым раствором и тщательно перемешивают. Далее проводят анализ в соответствии с одним из предложенных вариантов.
Вариант 1. Метод градуировочного графика
Сущность метода. Готовят серию стандартных растворов, содержащих Особенностью данного графика является использование полулогарифмической системы координат. В этом случае зависимость сигнала от логарифма концентрации получается прямолинейной. Выполнение анализа. Измеряют потенциал нитрат-селективного электрода относительно хлоридсеребряного в анализируемом растворе (Ех) и по градуировочному графику определяют рNO3. Используя полученное значение, рассчитывают концентрацию, а затем – массу Вариант 2. Метод однократной добавки
Сущность метода. При определении методом однократной добавки к определенному объему анализируемого раствора добавляют точно отмеренное количество стандартного раствора определяемого иона и фиксируют значение потенциала до (Eх) и после прибавления стандартного раствора (Eх+ ст). Расчет проводят по уравнению Нернста. Например, для нитрат-селективного электрода (z = –1): Eх = const – Θ lg Cx, (3.1) Eх+ ст = const – Θ lg Cx+ ст, (3.2) где Θ – экспериментально определенное значение наклона электродной функции; Cx – концентрация нитрат-ионов в анализируемом растворе, моль/л; Cx+ ст – концентрация нитрат-ионов в анализируемом растворе после добавления стандартного раствора, моль/л: Cx+ ст = Решением системы уравнений (3.1) и (3.2) находят концентрацию нитрат-ионов Cx в анализируемом растворе. Выполнение анализа. В стакан для измерений внести 20, 0 мл полученного анализируемого раствора, провести измерение потенциала Ех при перемешивании. Не вынимая электродов из раствора и не отключая мешалку, с помощью градуированной пипетки вместимостью 5, 0 мл внести в стакан несколько миллилитров стандартного 0, 1000 М раствора KNO3 (3–5 мл) так, чтобы изменение потенциала составило около 30 мВ. Отметить значение потенциала Eх+ ст и точный объем добавленного стандартного раствора Vст. Составить систему уравнений (3.1) и (3.2) и решить ее относительно неизвестной концентрации Cx. Используя полученное значение, рассчитать массу
|

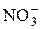 в пробе (г), используя следующие приемы нахождения неизвестной концентрации:
в пробе (г), используя следующие приемы нахождения неизвестной концентрации:
 . После проведения измерений строят график в координатах Е – р С и рассчитывают коэффициент селективности по точке пересечения экстраполированных линейных участков, дающей минимальное значение С min(
. После проведения измерений строят график в координатах Е – р С и рассчитывают коэффициент селективности по точке пересечения экстраполированных линейных участков, дающей минимальное значение С min( ,
, .
.


