Перша допомога при нещасних випадках
1. Коли на руку чи обличчя попадає кислота, її треба змити сильним струменем води, а потім промити 5%-ним розчином питної соди. 2. Якщо на шкіру потрапить луг, його необхідно промити сильним струменем води, а потім 1%-ним розчином оцтової кислоти. 3. Коли луг потрапить в очі, треба добре промити очі водою, а потім 2%-вим розчином Н3ВО3. 4. При попаданні в очі кислоти, слід промити їх водою, а потім 3%-вим розчином NaHCO3. 5. При порізах склом потрібно видалити з рани скло(якщо треба – то пінцетом), а потім змити кров 2%-вим розчином KмnO4 і змазати розчином йоду, перев’язати бинтом. 6. Невелику пожежу слід гасити протипожежною ковдрою або засипати піском. 7. Якщо при горінні виділяються отруйні гази слід скористатися протигазом і викликати пожежну команду (по телефону 01). 8. При пропусканні газових кранів викликати газову службу по телефону 104.
ОФОРМЛЕННЯ ЗВІТІВ ЛАБОРАТОРНИХ РОБІТ Звіти оформляються в окремому зошиті об’ємом біля 50 листів. На титульній сторінці слід писати: ЖУРНАЛ для лабораторних робіт з загальної та неорганічної хімії студента групи __________________________ (Прізвище, ім’я, по-батькові) Лабораторні роботи, що супроводжуються пробірочними дослідами з написанням рівнянь хімічних реакцій оформляються на двох сторінках журналу за такою схемою:
Більш складні лабораторні роботи оформляються відповідно до методики, наведеної у цьому посібнику.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Робота 1. Реакція середовища при дії індикаторів. У 3 пробірки налити 3-5 крапель NaOH. Потім до першої додати 2 краплі розчину лакмусу, до другої - фенолфталеїну, до третьої - метилоранжу. Що спостерігається? Зробити висновок. Аналогічно провести дослід з Н2SO4.
Робота 2. Властивості оксидів. 2.1. Взаємодія оксидів з водою. Маленьку грудочку кальцій оксиду збовтати в пробірці з 1, 5-2 см3 води. Реакцію розчину перевірити фенолфталеїном (2-3 краплі). Скласти рівняння реакцій. Зробити висновок про хімічний характер кальцій оксиду.
2.2. Взаємодія оксидів з кислотами і лугами. У дві пробірки внести після крупиць магній оксид. В одну пробірку долити 1, 5-2см3 розведеної хлоридной кислоти, а в іншу - 1, 5-2см3 концентрованого натрію гідроксиду. Скласти рівняння реакцій. Зробіть висновок про хімічний характер магній оксиду. Аналогічні дослідження провести з кальцій оксидом та алюміній оксидом. Робота 3. Властивості основ. 3.1. Отримання основ. У окремі пробірки налити по 2 мл розчинів солей: нікель сульфату, кальцій хлориду, хром хлориду, цинк сульфату і кобальту хлориду. До кожної пробірки долити краплями розведеного розчину натрій гідроксиду до утворення осадів. Що це за осади? Написати рівняння реакцій їх утворення.
3.3. Властивості основ. Вміст кожної пробірки з досліду
3.3.1. Збовтати і розділити на дві частини. До однієї долити розведеної хлоридной кислоти, а до іншої - концентрованого розчину натрію гідроксиду. Описати спостереження. Скласти рівняння реакцій. Зробити висновок про хімічну природу гідроксидів.
Робота 4. Властивості кислот. 4.1. Взаємодія з металами. У три пробірки внести по 1-2 см3 розведеної Н2SO4 і по шматочку таких металів: Zn, Cu, Fe, Mg. Описати спостереження. Скласти рівняння реакцій.
4.2. Взаємодія з основами. У пробірку налити 1 см3 розчину гідроксиду натрію. Додати 1 краплю індикатору метил-оранжу. Додати 5 капель розведеної сульфатної кислоти. Що спостерігається? Написати відповідне рівняння реакції. Розділ 7. РОЗЧИНИ. План §7.1. Розчини. Класифікація розчинів. §7.2. Розчинність речовин у воді. §7.3. Способи вираження концентрації розчинів: а) масова частка речовини (відсоткова концентрація); б) молярна концентрація речовини (молярність); в) молярна концентрація еквівалентів речовини (нормальність). §7.4. Приклади розв’язування задач за темою «Розчини». §7.1. Розчини. Класифікація розчинів
Значення розчинів. В природі, в житті людини і тварин розчини мають величезне значення. Всі найважливіші фізіологічні рідини (цитоплазма клітини, кров, лімфа, шлунковий сік та інше) – це розчини. Ліки – це переважно розчини.Надходження поживних речовин в клітину і видалення з неї продуктів розпаду відбувається у вигляді розчинів. Процес розчинення зумовлений взаємодією частинок розчиненої речовини і розчинника: 1. РОЗЧИННИК (середовище), наприклад, вода 2. РОЗЧИНЕНА РЕЧОВИНА (фаза), наприклад, сіль.
РОЗЧИННИК – це компонент розчину, який знаходиться в такому ж агрегатному стані, що і розчин. Якщо розчини утворюють речовини в однакових агрегатних станах (наприклад, спирт + H2О), розчинником вважається той компонент, якого більше. КЛАСИФІКАЦІЯ РОЗЧИНІВ 1. За агрегатним станом розчини діляться на: а) рідкі (кислота у воді, кров, шлунковий сік, молоко); б) тверді (сплави металів, мінерали, ґрунт); в) газоподібні (повітря, дим, туман). 2. За розміром частинок фази виділяють: а) істинні розчини (частинки фази менше 1 нанометра (1•10–9 м)). Наприклад, розчин солі, цукру, кислоти у воді. Властивості істинних розчинів дуже стабільні: вони не розшаровуються з часом, прозорі для світла. Багато ліків – це істинні розчини, вони легко всмоктуються в кишківнику і потрапляють в кров. б) колоїдні розчини ( частинки фази менше 10-7м, але більше Наприклад, розчини білків, кров, цитоплазма, лімфа – це рідкі розчини; туман, смог, хмари – це газоподібні; желе, мозкова, хрящова тканині - це тверді колоїдні розчини. 3. За кількістю розчиненої речовини розчини ділять на: а) РОЗВЕДЕНІ (ω < 25 %) та КОНЦЕНТРОВАНІ (ω > 25 %). б) НАСИЧЕНІ, НЕНАСИЧЕНІ, ПЕРЕСИЧЕНІ. НАСИЧЕНИЙ РОЗЧИН – це розчин, в якому дана речовина при даній температурі вже більше не розчиняється. У насиченому при певній температурі розчині міститься максимально можлива кількість розчиненої речовини. Концентрація речовини в насиченому розчині дорівнює розчинності цієї речовини.(Наприклад, якщо помістити 50 г NaCl в 100 г H2O, то при 20°C розчиниться тільки 36 г солі) НЕНАСИЧЕНИЙ РОЗЧИН – це розчин, в якому дана речовина ще може розчинятися. (Наприклад, помістившив 100 г води при 20°C менше 36 г NaCl отримаємо ненасичений розчин). Утворення каміння в нирках і жовчному міхурі, відкладення солей при остеохондрозі пов'язано з перетворенням ненасичених розчинів в насичені. ПЕРЕСИЧЕНІ РОЗЧИНИ – це нестабільні системи. Їх одержують шляхом повільного охолоджування насичених при більш високій температурі розчинів. §7.2. Розчинність речовин у воді Здатність речовини розчинятися в розчиннику, називається РОЗЧИННІСТЮ. Існують добре і мало розчинні речовини. Кількісно розчинність виражають числом грамів речовини, яка може розчиниться в 100 г розчинника (води) при даній температурі. Розчинність залежить від природи речовини і розчинника, від температури і від тиску (для газів). Розчинність більшості твердих речовин збільшується з підвищенням температури. Залежність розчинності (Р) твердих речовин від температури показують КРИВІ РОЗЧИННОСТІ. Вони допомагають знаходити розчинність речовин при різній температурі розчинів.
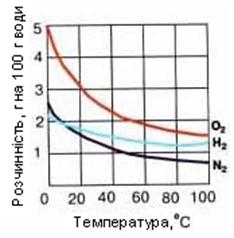
Рис. 7.1. Криві розчинности твердих (а) і газоподібних (б) речовин.
Розчинність газів при підвищенні температури зменшується, а при підвищенні тиску збільшується. - Природа розчинника. При утворенні розчину зв'язок між частинками кожного з компонентів замінюється зв'язками між частинками різних компонентів. Щоб нові зв'язки могли утворитися, компоненти розчину повинні мати однотипні зв'язки, тобто бути однієї природи. Тому йонні речовини добре розчиняються в полярних розчинниках і погано в неполярних, а молекулярні речовини – навпаки. - Вплив температури. Якщо розчинення речовини є екзотермічним процесом, то з підвищенням температури її розчинність зменшується (наприклад, Ca(OH)2 у воді) і навпаки. Для більшості солей характерне збільшення розчинності при нагріванні. Практично всі гази розчиняються з виділенням тепла. Розчинність газів в рідинах з підвищенням температури зменшується, а з пониженням збільшується. - Вплив тиску. З підвищенням тиску розчинність газів в рідинах збільшується, а з пониженням зменшується. Тиск не впливає на розчинність твердих речовин. Зате збільшення тиску підвищує розчинність газів. В цьому можна переконатися, відкривши пляшку з мінеральною водою, в якій вуглекислий газ розчиняють під тиском. Як тільки пляшку відкривають, тиск в ній падає і тут же зменшується розчинність газу, який починає виділятися з розчину у вигляді бульбашок.
МЕХАНІЗМ РОЗЧИНЕННЯ Розчинення – це складний фізико-хімічний процес, який складається з трьох стадій: 1. Гідратація (сольватація) молекул або йонів речовини молекулами розчинника, що розчиняється(екзотермічний процес Δ Q1> 0). Розчини утворюються при взаємодії розчинника і розчиненої речовини. Процес взаємодії розчинника і розчиненої речовини називається СОЛЬВАТАЦІЯ (якщо розчинником є вода – ГІДРАТАЦІЯ) 2. Руйнування кристалічних ґраток (ендотермічний процес Δ Q2< 0). 3. Дифузія гідратів (сольватів) в розчині (мимовільний процес Δ Q3=0). Залежно від співвідношення теплових ефектів Q1 і Q2 процес розчинення може бути екзо- або ендотермічним.
§7.3. Способи вираження концентрації розчинів На практиці часто доводиться мати справу з розчинами, що мають точно заданий вміст в них розчиненої речовини. Приведемо декілька прикладів. · По-перше, це приготування різних лікарських розчинів. Якщо в аптеці випадково відбудеться помилка з кількістю ліків в розчині, то наслідки можуть бути досить небезпечними. · По-друге, багато хімічних реакцій проводять в розчинах. І тут помилки можуть приводити до сумних результатів. Наприклад, якщо фотограф помилиться при розчиненні проявника, то фотографії або не проявляться, або будуть зіпсовані. Інший приклад: якщо залити в акумулятор розчин, в якому вміст сірчаної кислоти буде меншим або більшим за потрібний, то акумулятор або не працюватиме, або вийде з ладу. КОНЦЕНТРАЦІЯ РОЗЧИНУ – це кількість розчиненої речовини, яка міститься в певній масі або об'ємі розчину. Існують різні способи вираження складу розчину. Найбільш часто використовують масову частку розчиненої речовини, молярну концентрацію і молярну концентрацію еквівалента. а) Масова частка розчиненої речовини – ω (%) б) Молярна концентрація – СМ (моль/л) в) Молярна концентрація еквівалента – СЕ (моль∙ екв/л)
mрозчину = m(Н2О)+ mречовини Масова частка – показує, скільки грамів речовини міститься в кожних 100 грамах розчину. Наприклад: 10% СаСl2 – десятивідсотковий розчин хлориду кальцію, тобто кожні 100 грамів розчину містять 10 грамів хлориду кальцію і 90 грамів води. Масову частку розчиненої речовини називають також ВІДСОТКОВОЮ КОНЦЕНТРАЦІЄЮ розчину. Для газів використовують ОБ’ЄМНУ ЧАСТКУ – що показує, скільки мл речовини міститься в кожних 100 мл розчину. Густина розчину (ρ) (читається “ро”) показує масу 1 мілілітра (мл) розчину. Наприклад, ρ (H2SO4) = 1, 84 г/мл. Це значить, що кожний мілілітр розчину сірчаної кислоти має масу 1, 84 грам
mречовини = С•М•V(л) = С•М•V(мл) /1000 де v – кількість речовини (моль) mречовни – маса речовини (грам) V – об'єм розчину (мл, літр ) М – молярна маса речовини (г/моль ). Молярна концентрація вимірюється в моль/л і позначається " M";. Наприклад. Якщо кожний літр розчину містить 1 моль речовини, такий розчин називається ОДНОМОЛЯРНИЙ і позначається 1 М. 2 M NaOH - двохмолярний розчин гідроксиду натрію. Один літр такого розчину містить 2 моль речовини або 80 г (M(NaOH)= 40 г/моль).
Е – еквівалент речовини. ГРАМ - ЕКВІВАЛЕНТОМ речовини називається кількість грамів речовини, що дорівнює його еквіваленту. МЕ (молярна маса еквіваленту) = М / валентність елементу Наприклад для А1: MЕ ( Для кислот: Е = 1/кількість Н+, які заміщуються в даній реакції: Для Н2SO4: МЕ ( Для основ: Е = 1/кількість ОНˉ ):
Для солей: Е = 1/валентність атомів металу•кількість атомів Для Al2 (SO4)3:
Формули для знаходження молярної концентрації за відомою відсотковою концентрацією і навпаки (ω « С)
§7.4. Приклади розв’язування задач за темою «Розчини» Задача 1. У воді об'ємом 400 мл розчинили сіль масою 80 грам. Визначити відсоткову концентрацію солі в розчині. Розв’язок: 1. Визначити масу води: m(Н2О)= V • r = 400 • 1 = 400(г). 2. Визначити масу розчину: mрозчину = m(Н2О)+ mречовини = 400 + 80 = 480(г). 3. Розрахувати відсоткову концентрацію солі в розчині: Задача 2. Скільки глюкози і води необхідно взяти для приготування 500 г 5% розчину для ін'єкцій. Розв’язок: 1. Знайдемо масу глюкози:
2. Знайдемо масу води: m (Н2О)= mрозчину – m(Н2О)= 500 – 25 = 475 г.
Задача 3. Яку масу хромату калія K2CrO4 потрібно узяти для приготування 1, 2 л 0, 1 М розчину? Розв’язок: m(K2CrO4) = С(K2CrO4) • V • M(K2CrO4)= = 0, 1 моль/л • 1, 2 л • 194 г/моль» 23, 3 г. Відповідь: Для приготування 1, 2 л 0, 1 М розчину потрібно взяти 23, 3 г K2CrO4 і розчинити у воді, а об'єм довести до 1, 2 літрів. Задача 4. Яка маса соляної кислоти міститься в шлунковому соку об'ємом 0, 2 літри, якщо молярна концентрація НCl в шлунковому соку дорівнює 0, 1 М. Розв’язок: 1. Знайти молярну масу НCl: М(HCl)= 1 + 35, 5 = 36, 5 ( г/моль) 2. Знайти масу НCl: m(HCl)= C • M • V = 0, 1 • 36, 5 • 0, 2 = 0, 73 (г).
Задача 5. Визначити молярність розчину сірчаної кислоти з відсотковою концентрацією 9, 8 % (ρ = 1, 18 г/мл). Розв’язок: (1 спосіб) 1. Визначимо масу 1 літра розчину кислоти: mр-ра = з • V = 1, 18•1000=1180 г 2. Визначимо кількість моль кислоти в розчині: 3. Знайти кількість моль кислоти в 1 літрі розчину, тобто молярність розчину: Розв’язок: (2 спосіб)
Задача 6. Розрахувати молярну концентрацію і нормальність 70%-ного розчину H2SO4 (r = 1, 615 г/мл). Розв’язок: Для обчислення молярності і нормальності треба знати масу H2SO4 в 1 л розчину. 70% -ний розчин H2SO4 містить 70 г H2SO4 в 100 г розчину. 1) Ця маса розчину займає об'єм 2) Отже, в 1 л розчину міститься:
3) Звідси, молярність даного розчину дорівнює:
4) Нормальність цього розчину (вважаючи, що кислота використовується в реакції як двоосновна) дорівнює:
|

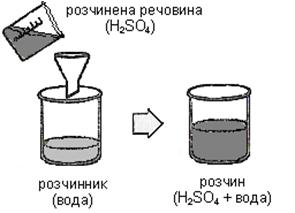 3. ПРОДУКТИ їх взаємодії (гідрати або сольвати) наприклад, гідратовані йони солі.
3. ПРОДУКТИ їх взаємодії (гідрати або сольвати) наприклад, гідратовані йони солі.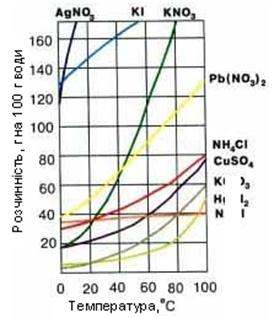
 Кристалічні речовини поділяють на:
P - добре розчинні (більше 1, 0 г на 100 г води);
M – малорозчинні (0, 1 г - 1, 0 г на 100 г води);
Н – нерозчинні (меньше 0, 1 г на 100 г води).
Кристалічні речовини поділяють на:
P - добре розчинні (більше 1, 0 г на 100 г води);
M – малорозчинні (0, 1 г - 1, 0 г на 100 г води);
Н – нерозчинні (меньше 0, 1 г на 100 г води).
 МАСОВА ЧАСТКА РОЗЧИНЕНОЇ РЕЧОВИНИ – це відношення маси розчиненої речовини mречовини до загальної маси розчину mрозчину, виражене у відсотках.
МАСОВА ЧАСТКА РОЗЧИНЕНОЇ РЕЧОВИНИ – це відношення маси розчиненої речовини mречовини до загальної маси розчину mрозчину, виражене у відсотках.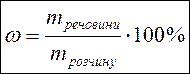
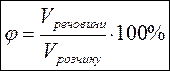
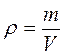 , де m – маса розчину, V – об'єм розчину.
, де m – маса розчину, V – об'єм розчину. , якщо V в мл, то
, якщо V в мл, то 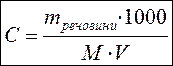
 , де СЕ - молярна концентрація еквівалента, моль-екв/л,
, де СЕ - молярна концентрація еквівалента, моль-екв/л, Аl)=
Аl)= 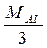 =
= 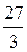 =9 г/моль
=9 г/моль
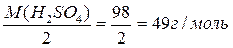
 Для Са(ОН)2: МЕ (
Для Са(ОН)2: МЕ (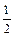 Са(ОН)2)=
Са(ОН)2)= 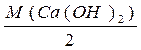 =
= 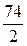 =37 г/моль
=37 г/моль = 57 г/моль
= 57 г/моль Молярну концентрацію еквівалентаречовини також називають НОРМАЛЬНІСТЮ розчину. Величини нормальності позначають буквою " Н". Наприклад, децинормальный розчин сірчаної кислоти позначають " 0, 1 Н розчин H2SO4".
Молярну концентрацію еквівалентаречовини також називають НОРМАЛЬНІСТЮ розчину. Величини нормальності позначають буквою " Н". Наприклад, децинормальный розчин сірчаної кислоти позначають " 0, 1 Н розчин H2SO4".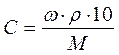

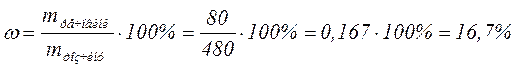
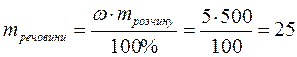 г
г (моль)
(моль)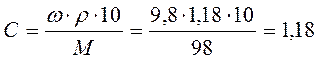 М.
М. М.
М.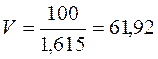 мл
мл г (H2SO4)
г (H2SO4)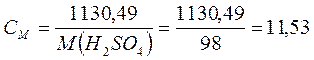 M (моль/л)
M (моль/л)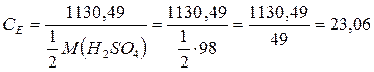 H (моль-екв/л)
H (моль-екв/л)


