ЗАНЯТТЯ №22
Лабораторна робота №3. Тема: Приготування розчинів з заданою масовою часткою та молярною концентрацією Актуальність: Використання розчинів різної концентрації в лікарській практиці вимагає знання способів вираження концентрацій та вміння приготування розчинів для практичного використання. Навчальні цілі: Знати: класифікацію розчинів, масову та об'ємну частки розчиненої речовини, способи вираження концентрації розчинів, правила приготування розчинів. Вміти: визначати концентрацію розчину, переводити один вид концентрації в інший, розраховувати необхідну кількість компонентів та готувати розчини з заданою масовою часткою або молярною концентрацією. Самостійна позааудиторна робота студентів. ! Написати в робочому зошиті: 1. Обчислити масу сірчаної кислоти (H2SO4), необхідну для приготування 2 л 50% розчину (ρ = 1, 39 г/мл). 2. Яка масова частка нітрату калію (KNO3) в розчині, одержаному при розчиненні нітрату калію масою 20 г у воді масою 180 г. 3. Чому дорівнює масова частка калій хлориду, якщо 40 г його розчинили у воді масою 200 г: а) 40 %; б) 20 %; в) 16, 7 %; г) 33, 4 % 4. Обчислити масову частку сульфатної кислоти в 1, 5 М розчині H2SО4 (ρ = 1, 1 г/см3): а) 14, 7 %; б) 11, 3 %; в) 12, 5 %; г) 15, 6 %. 5. Визначити молярну концентрацію 36, 2 %-го розчину HCl (ρ = = 1, 18 г/см3): а) 11, 7 моль/л; б) 23, 4 моль/л; в) 35, 1 моль/л; г) 46, 8 моль/л. 6. Скільки грамів Na2SO4 необхідно взяти для приготування 2 л 8 %-го розчину натрій сульфату (ρ = 1, 08 г/см3): а) 172, 8 г; б) 216 г; в) 1728 г; г) 212, 8 г 7. Визначити масу натрій нітрату, необхідного для приготування 300 мл 0, 2 М його розчину: а) 60 г; б) 5, 1 г; в) 6 г; г) 12 г. ! Дати відповіді на тести: 1. Яку масу натрій гідроксиду необхідно взяти, щоб приготувати 150 г його розчину з масовою часткою 20 %: а) 10 г; б) 20 г; в) 30 г; г) 40 г; д) 50 г; 2. Чому дорівнює масова частка калій сульфату, якщо для приготування розчину взято 40 г солі та 60 г води: а) 25 %; б) 20 %; в) 50 %; г) 40 %; д) 10 %. 3. Обчислити масову частку сульфатної кислоти в 2 М розчині H2SО4 (ρ = 1, 1 г/см3): а) 14, 7 %; б) 11, 3 %; в) 12, 5 %; г) 16, 3 %; д) 17, 8 %. 4. Визначити молярність 25 % -го розчину натрій гідроксиду (ρ = 1, 2 г/см3): а) 6 моль/л; б) 6, 5 моль/л; в) 7 моль/л; г) 7, 5 моль/л; д) 8 моль/л. 5. Чому дорівнює масова частка калій хлориду, якщо 25 г його розчинили в воді масою 100 г: а) 40 %; б) 20 %; в) 16, 7 %; г) 20%; д) 30 %. Самостійна робота на занятті Кожний студент отримує завдання розрахувати необхідні маси розчиненої речовини та води для приготування розчинів з заданою масовою часткою та молярною концентрацією.
ТЕХНІКА ПРИГОТУВАННЯ РОЗЧИНУ З ЗАДАНОЮ КОНЦЕНТРАЦІЄЮ: А) ВІДСОТКОВОЮ (масовою часткою розчинної речовини). 1. Знайти масу речовини в розчині за формулою:
2. Знайти масу води в розчині за формулою: m(Н2О) = mр-ну – m(Н2О)
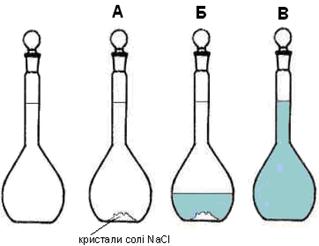
3. Зважити необхідну кількість речовини на терезах. 4. Виміряти необхідний об’єм води за допомогою мірного посуду, V (Н2О) = m (Н2О) оскільки густина воду дорівнює 1г/мл. 5. З’єднати речовину та воду, розчинити речовину. 6. Розчин готовий. Б) МОЛЯРНОЮ. 1. Знайти масу речовини в розчині за формулою: mр-ни = С•М•V (л) 2. В мірній колбі розчинити цю речовину в воді. 3. Довести розчин водою до заданого об’єму. 4. Розчин готовий. Наприклад, потрібно одержати розчин натрію хлориду у воді з концентрацією солі 1 моль/л. Для цього існують спеціальні мірні колби (мал. 7.2). Мірна колба є посудиною з тонкою шийкою, на якій по склу нанесена мітка. Якщо заповнити мірну колбу рідиною до мітки, то її об'єм складе рівно 1 л.
Мал. 7.2. Послідовність приготування молярного розчину хлориду натрію (1моль/л NaCl). А В мірну колбу обємом 1 л поміщають наважку кристалічного NaCl. Б В колбу додають трохи води і ретельно перемішують. В Розчиняють кристали і доливають розчин дистильованою водою до мітки 1.
А. Приготувати розчин з заданою відсотковою концентрацією: 1. Знайти масу речовини та масу розчинника для приготування 200 г 12% розчину фруктози (густина розчину 1, 15 г/см3). 2. Знайти масу речовини та масу розчинника для приготування 1000 г 1% розчину глюкози (густина розчину 1, 01 г/см3). 3. Знайти масу речовини та масу розчинника для приготування 500 г 8% розчину алюміній сульфіту (густина розчину 1, 1 г/см3). 4. Знайти масу речовини та масу розчинника для приготування 220 г 10% розчину натрію карбонату (густина розчину 1, 12 г/см3). 5. Знайти масу речовини та масу розчинника для приготування 415 г 0, 1% розчину літію броміду (густина розчину 1, 0 г/см3). 6. Знайти масу речовини та масу розчинника для приготування 42 г 6% розчину натрію гідроксиду (густина розчину 1, 05 г/см3). 7. Знайти масу речовини та масу розчинника для приготування 142 г 16% розчину ферум (ІІІ) хлориду (густина розчину 1, 2 г/см3).
Б. Приготувати розчин з заданою молярною концентрацією: 1. Знайти масу речовини, необхідну для приготування 125 мл 0, 2 М розчину кальцію хлориду. 2. Знайти масу речовини, необхідну для приготування 50 мл 5 М розчину натрію карбонату. 3. Знайти масу речовини, необхідну для приготування 180 мл 0, 15 М розчину алюміній сульфату. 4. Знайти масу речовини, необхідну для приготування 50 мл 0, 2 М розчину магнію хлориду. 5. Знайти масу речовини, необхідну для приготування 350 мл 1 М розчину калію сульфату. 6. Знайти масу речовини, необхідну для приготування 155 мл 0, 05 М розчину магнію нітрату. 7. Знайти масу речовини, необхідну для приготування 450 мл 0, 01 М розчину натрію силікату.
В. Приготувати розчин з заданою молярною концентрацією еквівалентів: 1. Знайти масу речовини, необхідну для приготування 500 мл 0, 1 н розчину натрію сульфату. 2. Знайти масу речовини, необхідну для приготування 1000 мл 2 н розчину ферум (ІІІ) сульфату. 3. Знайти масу речовини, необхідну для приготування 500 мл 3 н розчину алюмінію хлориду. 4. Знайти масу речовини, необхідну для приготування 200 мл 0, 1 н розчину цинку нітрату. 5. Знайти масу речовини, необхідну для приготування 1000 мл 0, 01 н розчину алюміній нітрату. 6. Знайти масу речовини, необхідну для приготування 100 мл 0, 02 н розчину натрію сульфату. 7. Знайти масу речовини, необхідну для приготування 100 мл 0, 32 н розчину алюмінію сульфату.
Розділ 8. ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ. рН РОЗЧИНІВ План §8.1. Положення теорії електролітичної дисоціації. §8.2. Особливості розчинів кислот, основ та солей. §8.3. Ступінь дисоціації. Сильні та слабкі електроліти. Константа дисоціації. §8.4. Йонні рівняння реакцій. §8.5. Дисоціація води. Водневий показник. рН розчинів. §8.6. Гідроліз солей. Ступінь та константа гідролізу.
§ 8.1. Положення теорії електролітичної дисоціації
ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ (розробив шведський учений Сванте Арреніус в 1887 році, доповнили російські учені Д.І.Менделєєв, Й.Каблуков та В.Кистяковский). · 1. Всі речовини діляться на електроліти та неелектроліти. ЕЛЕКТРОЛІТИ – це речовини, розчини і розплави яких проводять електричний струм (кислоти, луги, розчинні солі). Розчини НЕЕЛЕКТРОЛІТІВ не проводять електричний струм. До неелектролітів відносяться оксиди, нерозчинні неорганічні речовини та всі органічні речовини (крім кислот). · 2. Молекули електролітів у воді розпадаються на йони: КАТІОНИ (+) таАНІОНИ (–) · 3. Сума зарядів катіонів в розчині дорівнює сумі заряді аніонів. Тому розчин – електронейтральний. Наприклад, для Al2(SO4)3 –– 2 • (+3) + 3 • (-2) = +6 - 6 = 0 · 4. Дисоціація – оборотній процес («). Паралельно з дисоціацією (®) йде асоціація (). Наприклад, рівняння дисоціації молекули електроліту КА на катіон К+ та аніон А- записується так:
· 5. Йони в розчині рухаються хаотично. Але при пропусканні електричного струму через розчин катіони починають рухатися до катода, аніони – до анода. На електродах відбувається електроліз. · 6. Властивості молекул та йонів – різні. Наприклад, Сl2 – газ, зеленого кольору, з різким, неприємним запахом, ОТРУТА. Сl– в розчині ні запаху, ні кольору не має, корисний для організму. · 7.Реакціїв розчинах електролітів йдуть між йонами. Реакції йдуть у бік утворення слабших електролітів, ніж початкові.
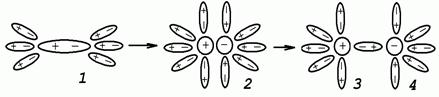
Причини та умови електролітичної дисоціації. 1. Молекули електроліту повинні бути полярні (зв'язки в молекулах іонні або ковалентні полярні). 2. Молекули розчинника також повинні бути полярними. Вода – найполярніший розчинник. 3. Між молекулами електроліту та розчинника має відбуватись взаємодія. Електроліт повинен бути розчинним у воді (гідрофільним). МЕХАНІЗМ ДИСОЦІАЦІЇ: Процес дисоціації ділиться на три стадії: 1. Гідрофільна речовина у воді притягає деяку кількість диполів води. Ця взаємодія називається ГІДРАТАЦІЯ кристалу або молекули. Це – екзотермічний процес, Δ Q> 0, Δ Н< 0. 2. Сили взаємодії речовини з водою приводять до РУЙНУВАННЯ кристала або молекули та ДИСОЦІАЦІЇ. Це – ендотермічний процес. Δ Q< 0, Δ Н> 0. 3. Потім відбувається ДИФУЗІЯ гідратованих йонів. Дифузія – самовільний процес. Δ Q = 0, Δ Н = 0.
Гідратація йонів (у загальному випадку – сольватація) – основна причина дисоціації. Вона частково ускладнює їх зворотне сполучення в молекулу. Гідратовані йони можуть мати як сталу, так і змінну кількість молекул води. Гідрат сталого складу утворює йон водню Н+ з молекулою води – Н3О+, його називають йоном гідроксонію. У розчинах існують тільки йони Н3О+, які для спрощення умовно позначають символом Н+.
§ 8.2. Особливості розчинів кислот, основ та солей 1. ДИСОЦІАЦІЯ КИСЛОТ НCl D Н+ +Сl– H2SO4 D 2 Н+ + SO42– КИСЛОТИ – це електроліти, які у водному розчині дисоціюють з утворенням йона Н+ (протону водню) та кислотного залишку (аніону кислоти). Багатоосновні кислоти дисоціюють ступінчато: H2SO4 « Н+ + HSO4– 1 ступінь HSO4– « Н+ + SO42– 2 ступінь Н3РО4 « Н+ + H2PO4– « Н+ + HPO42– « Н+ + PO43– Перший ступінь йде більш активно, ніж другий, а другий більш активно, ніж третій. Проте, Н+ може існувати самостійно тільки в газах, в розчинах Н+ миттєво приєднується до молекули Н2О за донорно-акцепторним механізмом та утворює [Н3О+] – йон гідроксонію. Н+ + Н2О ® [Н3О+] Окрім йону Н3О+, інших позитивно заряджених йонів в розчинах кислот не утворюється. [Н3О]+ додає розчину кислий смак, створює кисле середовище (рН < 7) та змінює забарвлення індикаторів.
2. ДИСОЦІАЦІЯ ОСНОВ. NaOH D Na+ + ОН– ОСНОВИ - це електроліти, які в розчинах дисоціюють з утворенням катіону металу та гідроксид аніону (ОН–). Основи, які мають декілька груп ОН– дисоціюють ступінчасто: Mg(OH)2 D MgOН+ + ОН– « Mg2+ + ОН– Крім ОН– – йонів, інших негативно заряджених йонів в розчинах основи не утворюють. ОН–-йони створюють лужне середовище розчину (рН> 7) та змінюють забарвлення індикаторів.
3. ДИСОЦІАЦІЯ СОЛЕЙ. СОЛІ – це електроліти, які при дисоціації утворюють катіони металу та аніон кислотного залишку. Середні солі дисоціюють повністю, кислі, основні та комплексні – ступінчасто, але ступінь дисоціації за другим ступенем дуже малий: KNO3 D К+ + NO3–, Na2CO3 D 2Na+ + СО32–, СаCl2 « Са2+ + 2Сl– Zn(OH)NО3 D Zn(OH)+ + NО3– 1 ступінь Zn(OH)+ D Zn2+ + ОH– 2 ступінь NaHSiO3 D Na+ + HSiO3– 1 ступінь HSiО3– D Н+ + SiО32– 2 ступінь
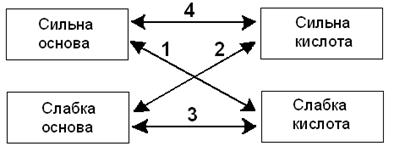
§8.3. Ступінь дисоціації. сильні та слабкі електроліти. Константа дисоціації. Оскільки електролітична дисоціація – процес оборотний, в розчинах електролітів разом з йонами є й молекули. Тому розчини електролітів характеризуються:
Якщo α = 0, то дисоціації немає, а якщо α = 1 або 100 %, то електроліт повністю розпадається на іони. Ступінь дисоціації залежить від природи речовини і розчинника, температури і концентрації розчину. Ступінь дисоціації зростає при збільшенні температури і при розбавленні розчину, тобто при зменшенні концентрації речовини в розчині. За ступеню дисоціації, всі електроліти діляться на СИЛЬНІ та СЛАБКІ: · Сильні електроліти при розчиненні у воді повністю дисоціюють на іони; · Слабкі електроліти при розчиненні у воді лише частково дисоціюють на іони. Таблиця 8.1. Розподіл електролітів за ступенем дисоціації
2. КОНСТАНТА ДИСОЦІАЦІЇ (Кд) – дорівнює відношенню добутку молярних концентрацій йонів до молярної концентрації молекул. Це важлива характеристика електроліту.Чим більше Кд, тим сильніший електроліт, тим більше йонів він утворює. Константа дисоціації справедлива для слабких та середньої сили електролітів. Вона є константою рівноваги для реакції КА D К+ + А+
[A-] - концентрація аніонів; [KA] - концентрація молекул КА. Константа рівноваги не залежить від концентрації, а залежить тільки від температури, природи розчинника та розчиненої речовини.
§8.4. Йонні рівняння реакцій Згідно теорії електролітичної дисоціації, у водних розчинах молекули електролітів дисоціюють на йони, тому реакції в них протікають між йонами. Вони називаються йонними реакціями, а рівняння цих реакцій – йонними рівняннями. РЕАКЦІЇ ЙОННОГО ОБМІНУ – це реакції між йонами, які утворилися в результаті дисоціації електролітів. ПРАВИЛА СКЛАДАННЯ ЙОННИХ РІВНЯНЬ РЕАКЦІЙ 1 Розчинні у воді речовини повністю дисоціюють та знаходяться в розчині у вигляді йонів. 2. Нерозчинні у воді сполуки (прості речовини, оксиди, слабкі кислоти, слабкі основи та нерозчинні солі) не дисоціюють. 3. Речовини малодисоційовані, малорозчинні (ті, що випадають в осад (¯)) та газоподібні () зображають у вигляді молекул. 3. У реакціях використовують розчини речовин, тому навіть малорозчинні речовини знаходяться в розчинах у вигляді йонів. 4. Якщо малорозчинна речовина утворюється в результаті реакції, то при записі йонного рівняння її вважають нерозчинною. 5. Сума електричних зарядів йонів в лівій і в правій частинах рівняння повинна бути однаковою.
ПОРЯДОК СКЛАДАННЯ ЙОННИХ РІВНЯНЬ РЕАКЦІЇ 1. Записати молекулярне рівняння реакції, розставити коефіцієнти: MgCl2 + 2AgNO3 = 2AgCl ¯ + Mg(NO3)2 2. Визначити розчинність кожної з речовин за допомогою таблиці розчинності: MgCl2 + 2AgNO3 = 2AgCl ¯ + Mg(NO3)2 P Р Н Р 3. Записати повне йонне рівняння реакції, в якому розчинні речовини записують у вигляді йонів, а нерозчинні залишити у вигляді молекул: Mg2+ + 2Сl– + 2Ag++ 2NO3– = 2AgCl¯ + Mg2+ + 2NO3– 4. Скласти скорочене йонне рівняння, скоротити однакові йони з обох боків:
Сl– + Ag+= AgCl ¯
Умови безповоротності реакцій іонного обміну 1. Якщо утворюється осад ( ¯ ) (дивися таблицю 8.1 та таблицю розчинності в додатку): Рb(NO3)2 + 2КI = РbI2 ¯ + 2KNO3 РЬ2+ + 2I 2. Якщо виділяється газ( ) : Na2CO3 + H2SO4 = Nа2SO4 + Н2О + СО2 СОз2 3. Якщо утворюється малодисоційована речовина (H2О) Са(ОН)2 + 2HNO3 = Ca(NO3)2 + 2Н2О Н+ + ОН 4. Якщо утворюються комплексні сполуки (малодисоційовані комплексні йони): CuSO4 • 5Н2О + 4NH3 = [Cu(NH3)4]SO4 + 5Н2О Cu2+ + 4NH3 = [ Cu(NH3)4]2+
У тих випадках, коли немає йонів, які можуть зв'язуватися між собою з утворенням осаду, газу, малодисоційованих сполук (Н2О) або комплексних йонів реакції обміну оборотні (D), немає реакції, не утворюються нові речовини: Наприклад. NaCl + KNO3 D NaNO3 + КCl Na+ + Сl
ПРИКЛАД ЗАПИСУ реакції в молекулярному або йонному вигляді: а) молекулярне рівняння: Na2S + H2SO4 = Na2SO4 + H2S б) повне йонне рівняння: 2Na+ + S2 в) скорочене йонне рівняння: S2 Скорочене йонне рівняння показує • які йони беруть участь в утворенні продукту даної реакції • запис якісної реакції на дані йони
На основі йонного рівняння легко написати молекулярне. Для цього потрібно до йонів лівої частини приписати йони протилежного знаку, які б утворювали з вихідними йонами розчинні сполуки, потім такі ж самі йони і в тій самій кількості написати у правій частині рівняння, після чого об’єднати йони у відповідні молекули. Приклад, SО42-+ Ba2+ = BaSO4¯ 2K+ + 2NО3-= 2K++2NО3- K2SO4 + Ba(NO3)2 = BaSO4¯ + 2KNO3
§8.5. Дисоціація води. водневий показник. рН – розчинів Чиста вода дуже погано проводить електричний струм, але все-таки є слабким електролітом та в незначному ступені дисоціює на йони за реакцією: H2O D H+ + OH‾, За величиною електропровідності чистої води можна обчислити концентрацію іонів водню та іонів гідроксилу у воді. При 25°С вона дорівнює 10-7 моль/л. Напишемо вираз для константи дисоціації води:
У знаменнику дробу – концентрація недисоційованих молекул води, яку можна вважати постійною і визначити в 1 л, прийнявши масу 1 л води за 1000 г:
[H+] • [OH‾ ] =
Величина рН використовується для характеристики кислотності розчину. Якщо концентрація іонів водню дорівнює [H+], то pH = – lg [H+] · У чистій воді: [H+] = [OHˉ ] = 10-7 · У кислих розчинах: [H+] > [OHˉ ] і pH < 7 · У лужних розчинах: [H+] < [OHˉ ] і pH < 7 Наприклад. 1) Якщо молярна концентрація НCl в розчині дорівнює 10–3моль/л тоді рН = -lg•10–3 = 3, 2) Якщо молярна концентрація NaOH в розчині дорівнює 10–2моль/л рОН = -lg • 10–2 = 2, тоді рН = 14 – рОН = 14 – 2= 12
þ Для розчинів слабких електролітів, в яких кількість йонів значно менша за концентрацію кислоти чи основи треба знати значення ступеня або константи дисоціації.

згідно з законом Освальда С – концентраця розчину електроліту
Наочно значення рН зображає графік – шкала рН
Для вимірювання рН існують різні методи. Наближено реакцію розчину можна визначити за допомогою спеціальних реактивів, які називаються індикаторами. ІНДИКАТОР – це складна органічна речовина, яка змінює своє забарвлення залежно від рН розчину. У табл. 8.1 наведено характеристику деяких індикаторів.
þ Табл. 8.1. Найважливіші індикатори
§8.6. Гідроліз солей. Ступінь та константа гідролізу ГІДРОЛІЗ СОЛЕЙ Більшість реакцій гідролізу – оборотні: Pb(NO3)2 + H2O «Pb(OH)(NO3) + HNO3 Na2HPO4 + H2O «NaH2PO4 + NaOH У результаті гідролізу в розчинах багатьох солей утворюється кисле або лужне середовище. Деякі солі повністю розкладаються у воді, тобто повністю гідролізують і не можуть існувати у вигляді розчинів. В таблиці розчинності солей вони позначені знаком ( þ Реакція ГІДРОЛІЗУ

Ця реакція є зворотною до реакції утворення солей.
þ Реакція НЕЙТРАЛІЗАЦІЇ
Основи і кислоти можуть бути сильними і слабкими, тому солі можна розділити на чотири типи. þ ТИПИ СОЛЕЙ
Розглянемо реакції гідролізу цих типів солей.
1. Солі, утворені сильними основами і слабкими кислотами, гідролізують за аніоном, їх розчини мають лужне середовище (рН > 7). Приклади солей: Na2CO3; CH3COONa; KCN; Na2S; K2SiO3 Приклад рівняння гідролізу: K2SiO3 +2H2O = 2КОН + H2SiO3 2K+ + SiO32 SiO32 Висновок: 1. В реакції гідролізу бере участь АНІОН солі. 2. рН> 7, середовище розчину солі стає лужним. ü Якщо ліки гідролізують за аніоном і утворюють лужне середовище, приймати їх треба перед їжею, інакше вони нейтралізуються шлунковим соком. 2. Солі, утворені слабкими основами і сильними кислотами гідролізують за катіоном, їх розчини мають кисле середовище, рН< 7. Приклади солей: A12(SO4)3; FeCl3; CuBr2; NH4C1; Zn(NO3)2; (NН4)2Cr2O7. Приклад рівняння реакції гідролізу: FeCl3 + 3Н2О = Fe(OH)3 + 3НCl Fe3+ + 3Сl Fe3++ 3H2O = Fe(OH)3¯ + 3H+ Висновок: 1. В реакції гідролізу бере участь КАТІОН СОЛІ 2. рH< 7, середовище розчину солі стає кислим. ü Ліки, які гідролізуютьза катіоном і утворюють кисле середовище приймати треба після їжі, щоб не викликати подразнення слизової шлунку.
3. Солі, утворені слабкими основами і слабкими кислотами гідролізують за катіоном і аніоном, розчини цих солей мають нейтральне, слабокисле або слаболужне середовище, рН≈ 7. Приклади солей: A12S3; Cr2S3; CH3COONH4; (NH4)2CO3. Приклад реакції гідролізу: (NН4)2СО3 + 2Н2О = 2NH4OH + Н2СО3 2NH4+ + СO32 Висновок: 1. В реакції гідролізу бере участь КАТІОН і АНІОН СОЛІ 2. рН = 7. розчин має нейтральне середовище.
Якщо утворюється два слабкі електроліти, то гідроліз протікає необоротно. A12S3 + 6H2O = 2А1(ОН)3¯ + 3H2S Тому сульфід алюмінію не може існувати у вигляді водних розчинів, може бути одержаний тільки " сухим способом", наприклад, з елементів при високій температурі: 2A1 + 3S = A12S3 і повинен зберігатись в герметичних посудинах, в які не потрапляє волога. ü Якщо ліки піддаються повному гідролізу, вони поміщаються в капсули, які повинні розчинитися у визначеному місці шлунково-кишкового тракту.
4. Якщо сіль утворена ильною основою і сильною кислотою гідроліз не відбувається, середовище завжди (!) нейтральне, рН=7. Наприклад в розчинах NaCl, K2SO4, К2Сr2О7, Ba(NO3)2 гідроліз не відбувається. NaCl + Н2О = NaOH + HC1 Na+ + Сl Н2О = Н+ + ОН ü Якщо лікарські речовини не гідролізують, їх можна приймати у будь-який час і вводити у вигляді ін'єкцій безпосередньо в кров.
|



 СТУПЕНЕМ ДИСОЦІАЦІЇ (α), який дорівнює відношенню числа молекул, що розпалися на йони (n), до загального числа молекул (N) розчиненої речовини:
СТУПЕНЕМ ДИСОЦІАЦІЇ (α), який дорівнює відношенню числа молекул, що розпалися на йони (n), до загального числа молекул (N) розчиненої речовини:


 де [К+] - концентрація катіонів;
де [К+] - концентрація катіонів;
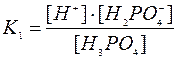
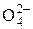

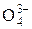


 завжди К1 > К2 > К3
завжди К1 > К2 > К3
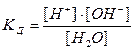 = 1, 8 • 10-16 (при 22°С)
= 1, 8 • 10-16 (при 22°С) моль
моль
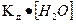 . або [H+] • [OH‾ ] = 1•10-14
. або [H+] • [OH‾ ] = 1•10-14
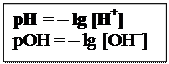 ВОДНЕВИЙ ПОКАЗНИК (рН) – це негативний десятковий логарифм молярної концентрації гідроген
ВОДНЕВИЙ ПОКАЗНИК (рН) – це негативний десятковий логарифм молярної концентрації гідроген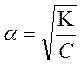 , де К – константа дисоціації слабкого електроліту,
, де К – константа дисоціації слабкого електроліту,