Експериментальна частина
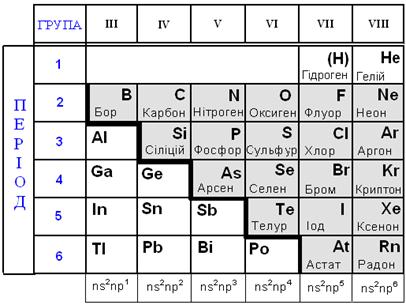
Робота 1. Взаємодія металів з кислотами. Взяти дві пробірки. В одну з пробірок вкинути шматочок міді, в другу – цинку. В кожну з пробірок влити по 2-3 см3 сульфатної кислоти. Що спостерігається? В якій з пробірок відбувається реакція? Чому? Записати пояснення в зошит. Написати рівняння відповідних реакцій. Вказати окисник і відновник. Робота 2. Визначення хімічної активності металів. А) Візати три пробірки. Налити в обидві пробірки по 2 см3 соляної кислоти. В одну з пробірок вкинути шматочок магнію, в другу – цинку, а в третю –міді. В якій з пробірок реакція відбувається найшвидше? Чому? Записати пояснення в зошит. Написати рівняння відповідних реакцій. Назвати одержані сполуки. Б) Взяти дві пробірки. В одну з пробірок налити 2 см3 розчину солі цинку, а в другу – стільки ж розчину солі Купруму (ІІ). У першу пробірку покласти шматочок міді, а у другу -– цинку. В якій з пробірок реакція відбувається реакція? Чому? Записати пояснення в зошит. Написати рівняння відповідних реакцій. Визначити відновник і окисник і вказати перехід електронів. Розділ 10. НЕМЕТАЛИ План §10.1. Загальна характеристика неметалів. §10.2. Гідроген (Водень). Будова атома, властивості. §10.3 VIІ А група. Галогени. §10.4. VI А група. Підгрупа Оксигену. §10.5. V А група. Підгрупа Нітрогену. §10.6. IV А група. Підгрупа Карбону §10.1. Загальна характеристика неметалів В періодичній системі зі 110 елементів є 22 неметали. Всі неметали р-елементи, тільки Гідроген і Гелій – s-елементи.
Атоми неметалів мають на зовнішньому енергетичному рівні чотири електрони і більше (тільки у Гідрогену – один, у Бору – три). Тому, атоми неметалів приєднують електрони для завершення зовнішнього енергетичного рівня. Тобто, атоми неметалів є ОКИСНИКАМИ. Здатність приєднувати електрони підвищується зі збільшенням порядкового номера металу в періоді та зменшується з його зростанням в групі. Здатність атомів елементів приєднувати до себе електрони знижується в ряді: F > O > N ≈ Cl > Br > I ≈ S ≈ C > P > H > Si > Al > Ca > K Флуор – найбільш електронегативний елемент і є найсильнішим окисником. З типовими металами неметали утворюють сполуки з йонним зв’язком (NaCl, K2S), а з неметалами – сполуки з ковалентним зв’язком (O2, N2 – ковалентний неполярний, CO2, NH3 – ковалентний полярний). Оксиди і гідроксиди неметалів мають кислотні властивості. Чим вищий ступінь окиснення (+5, +6, +7), тим сильніші кислотні властивості оксидів та гідроксидів. Наприклад, сульфатна кислота Н2S+6O4 є сильнішою за сульфітну Н2S+4O3, а нітроген (V) оксид N+52O5 має більш кислотні властивості, ніж нітроген (ІV) оксид N+4O2. З Гідрогеном неметали утворюють леткі сполуки (гази): Н2S, HCl, NH3.
Залежно від місця в періодичній таблиці та властивостей неметали поділяють на: · інертні гази (8А група), · галогени (7А група), · халькогени (6А група) тощо VIIІ А група - ІНЕРТНІ (благородні) ГАЗИ (He, Ne, Ar, Kr, Xe, Rn) мають стійкий завершений енергетичний рівень ns2nр6, тому є хімiчно малоактивними.
§10.2. Гідроген (Водень) Гідроген – 1-й Періодичної таблиці (заряд ядра 1), хімічний знак – Н, відносна атомна маса Ar=1 а.о.м. Є найпоширенішим елементом у Всесвіті (92%). Гідроген складає близько 70 % маси Сонця і зірок. В земній корі масова частка водню складає всього 1%. Найважливішим сполуками водню, що зустрічається в природі, є вода. В природі Гідроген знаходиться у вигляді трьох ІЗОТОПІВ:
Будова атома. Атом водню складається з ядра і одного електрона. Електронна конфігурація - 1s1. Є s-елементом. Молекула водню двохатомна:
Ступені окиснення Гідрогену в сполуках переважно +1 (Н2О, НCl) або -1 (тільки у гідридах металів NaH).Електронний рівень 1s вміщає не більше 2-х електронів і атому водню достатньо забрати або втратити один електрон, щоб досягти стійкої електронної конфігурації: Н - 1е‾ = Н+ позитивний йон водню (немає е‾) Н + 1е‾ = Н‾ негативний йон водню (1s2) Перше рівняння говорить про подібність Гідрогену з елементами I групи – лужними металами, які легко віддають єдиний зовнішній електрон і утворюють позитивні іони Li+, Na+, K+ і т.д. Друге рівняння свідчить про близькість Гідрогену до елементів VII групи, яким не вистачає одного електрона для завершення зовнішньої оболонки і які легко приймають чужий електрон з утворенням йонів F‾, Cl‾, Br‾ і т.д. Фізичні властивості. Водень - газ, безбарвний, без запаху; майже не розчиняється у воді, легший за повітря.
|