| 1) взаємодія активних металів з кислотами - неокисниками:
| Zn + 2HCl ®ZnCl2 + H2
|
| 2) взаємодія алюмінію (або цинку) з водними розчинами лугів:
| 2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
|
| 3) електроліз води і водних розчинів лугів і солей:
| 2H2O ®2H2 + O2
2NaCl + 2H2O ®H2 + Cl2 + 2NaOH
|
| 4) пропускання пари води над розжареним вугіллям при 1000°C:
| C + H2O ® CO + H2
|
| 5) конверсія метану при 900°C:
| CH4 + H2O ® CO + 3H2
|
| Методи (1, 2) використовують в лабораторії, (3-5) використовують в промисловості.
|
Хімічні властивості За звичних умов малоактивний (реагує тільки з фтором)
| ВІДНОВНІ ВЛАСТИВОСТІ: (H20 - 2ē ®2H+)
|
| 1) з неметалами:
| 2H20 + O2 ® 2H2+1O (з вибухом при підпалюванні)
|
|
| H20 + S –150-250 С® H2+1S
|
|
| H20 + F2 ®2HF (з вибухом) H2 + I2 t ® 2H+1I-1
|
|
| 3H20 + N2 p; t ® 2NH3+1 (у присутності каталізатора)
|
| 2) з оксидами металів:
| H20 + СuO –t ®Cu + H2O (метод отримання малоактивних металів Pb, Mo, W, Ni, Cu і ін. з їх оксидів)
|
| ОКИСНІ ВЛАСТИВОСТІ (H20 + 2ē ®2H-)
|
| 3) з лужними і лужноземельними металами:
| H20 + 2Li0 ® 2Li+1H-1
H20 + Ca0 ® Ca+2H2-1
|
| Гідриди Men+Hn– сильні відновники за рахунок водню в ступені окислення (-1). Розкладаються водою і кислотами:
NaH + H2O ®NaOH + H2
CaH2 + 2H2O ® Ca(OH)2 + 2H2
LiH + HCl ® LiCl + H2
|
§10.3. VII А група - ГАЛОГЕНИ
ГАЛОГЕНАМИ (від грец. halos - сіль и genes - утворюючий) – називають елементи головної підгрупи VII групи періодичної системи:
| Заряд ядра
| Назва
| Електронна конфігурація
| Ступені окиснення
| Атомний
радіус
| Електро-негативність
| Окисні
(неметалічні) властивості
|
|
| Флуор F
| 1s22s22p5
| -1
| зростає
————
| зменшується
———
| зменшуються
———
|
|
| Хлор Cl
| [Ne] 3s23p5
| -1, +1, +3, +4,
+5, +7
|
|
| Бром Br
| [Ar] 4s24p5
| -1, +1, +4, +5, +7
|
|
| Іод I
| [Kr] 5s25p5
| -1, +1, +3, +5, +7
|
|
| Астат At
| [Xe] 6s26p5
| -
|
Є СИЛЬНИМИ ОКИСНИКАМИ (найсильніший окисник – F). У ряді F - Cl - Br - І – Аt зменшуються неметалічні (окисні) властивості і збільшуються металічні (відновні) властивості.
Елементи 7А групи проявляють різні ступені окиснення від -1 до +7 (як виняток, F – тільки -1).
Загальні властивості галогенів:
1) Загальна електронна конфігурація зовнішнього енергетичного рівня - ns2np5. Всі вони р-елементи.
2) Із зростанням порядкового номера елементів збільшуються радіуси атомів, зменшується електронегативність, слабшають неметалічні властивості (збільшуються металеві властивості); галогени – сильні окисники, окисна здатність елементів зменшується із збільшенням атомної маси.
3) Молекули галогенів складаються з двох атомів.
4) Із збільшенням атомної маси забарвлення стає більш темним, зростають температури плавлення і кипіння, а також густина.
5) Сила галогеноводневих кислот зростає із збільшенням атомної маси.
6) Галогени можуть утворювати сполуки один з одним (наприклад, BrCl)
ХЛОР (Cl )
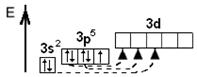
Електронна будова атома Хлору:
| | 17Сl 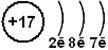
| 1s22 s22p6 3s23p5
|
| Разміщення електронів по орбіталям (останній шар)
| Ступінь окиснення
|
|
| - 1, +1
| НСl, Cl2O
|
| Збуджений стан атома
| –hν ® Cl* 
| +3
| HClO2
|
–hν ® Cl** 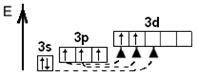
| +5
| НСlO3
|
–hν ® Cl*** 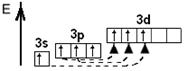
| +7
| НСlO4
|
| Фізичні
властивості
| Хлор – газ жовто-зеленого кольору. Розчинний у воді.
N Дуже отруйний.
|
| Одержання
| 1) Окислення йонів Cl- сильними окисниками (лабораторний спосіб):
| MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl ® 2MnCl2 + 5Cl2 + 2KCl + 8H2O
K2Cr2O7 + 14HCl ®2CrCl3 + 2KCl + 3Cl2 + 7H2O
|
| 2) електроліз розчину NaCl (промисловий спосіб):
| 2NaCl + 2H2O ®H2 + Cl2 + 2NaOH
|
| Хімічні
властивості
| Хлор - СИЛЬНИЙ ОКИСНИК
|
| реагує з:
|
| 1) з металами:
| 2Fe + 3Cl2 ®2Fe+3Cl3
|
| 2) з неметалами:
| H2 + Cl2 –h ® 2HCl
2P + 3Cl2 ® 2PClЗ
|
| 3) з водою:
| Cl2 + H2O ®HCl + HClO
|
| 4) з лугами:
| Cl2 + 2KOH ® KCl + KClO + H2O
|
|
| 5) Витісняє Br2 i I2 з їх солей і кислот Cl2 + 2KI ® 2KCl + I2
|
| | | | |
Найважливіші Сполуки
· хлористий водень (хлороводень) HCl
розчин HCl у воді – хлороводнева (солянакислота) є сильною кислотою:
HCl ® H+ + Cl-
солі – хлориди NaCl – натрій хлорид
| Фізичні властивості
| Безбарвний газ с різким запахом, отруйний, важчий за повітря, добре розчинний у воді.
|
| Одержання
| 1) Синтетичний спосіб (промисловий):
| H2 + Cl2 ®2HCl
|
| 2) Гідросульфатний спосіб (лабораторний):
| NaCl(тв.) + H2SO4(конц.) ® NaHSO4 + HCl
|
| Хімічні
властивості
| Реагує з
1) з металами (до Н2 в електрохімічному ряді):
|
2Al + 6HCl ® 2AlCl3 + 3H2
|
| 2) з оксидами металів:
| MgO + 2HCl ® MgCl2 + H2O
|
| 3) з основами і аміаком:
| HCl + KOH ® KCl + H2O
HCl + NH3 ® NH4Cl
|
| 4) з солями:
| CaCO3 + 2HCl ® CaCl2 + H2O +CO2
|
|
| þ Якісна реакція для виявлення йонів Cl‾
Утворення білого осаду хлориду срібла, нерозчинного в мінеральних кислотах:
AgNO3 + NaCl ® AgCl¯ (білий осад) + NaNO3
|
· Хлориди металів Ме+ХClх – солі соляної кислоти.
Їх одержують взаємодією:
| 1) металів з хлором
| 2Fe + 3Cl2 ® 2FeCl3
|
| 2) реакціями соляної кислоти з:
металами
|
Mg + 2HCl ®MgCl2 + H2
|
| оксидами
| CaO + 2HCl ® CaCl2 + H2O
|
| гідроксидами
| Ba(OH)2 + 2HCl ® BaCl2 + 2H2O
|
| 3) шляхом обміну з деякими солями
| Pb(NO3)2 + 2HCl ® PbCl2¯ + 2HNO3
|
Більшість хлоридів розчинні у воді (за винятком хлоридів срібла, свинцю і одновалентної ртуті).
§10.4. VI А група – Підгрупа Оксигену
Оксиген, сірка, селен, телур і полоній (полоній – радіоактивний елемент) – це елементи підгрупи VI групи, яка називається підгрупою Оксигену.
Елементи О, S, Se, Te мають групову назву ХАЛЬКОГЕНИ («ті, що народжують руди»).
Атоми халькогенів містять на зовнішньому енергетичному рівні по 6 електронів в стані s2p4. Цим пояснюється схожість хімічних властивостей. В ряду О – S – Se – Te зменшуються неметалічні (окисні) властивості, збільшуються металічні (відновні) властивості. Телур (Te) має амфотерні властивості.
|
| Заряд ядра
| Назва
| Електрона конфігурація
| Ступені окиснення
| Атомний
радіус
| Електро-негатив-ність
| Окисні
(неметалічні) властивості
|
| халькогени
|
| Оксиген О
| 1s22s22p4
| -2, -1, +2
| зростає
————
| зменшується
———
| зменшуються
———
|
|
| Сульфур S
| [Ne] 3s23p4
| -2, 0, +2, +4, +6,
|
|
| Селен Se
| [Ar] 4s24p4
| -2, 0, +2, +4, +6,
|
|
| Телур Te
| [Kr] 5s25p4
| -2, 0, +2, +4, +6,
|
|
|
| Полоній Ро
| [Xe] 6s26p4
| -
|
Проявляють ступені окиснення від -2 до +6 (тільки О2 має -2, -1 та +2).
Всі халькогени у сполуках з воднем і металами виявляють ступінь окиснення -2, а в сполуках з киснем та іншими активними неметалами – звичайно +4 і +6. Кисень виявляє ступінь окиснення звичайно -2, в пероксидах (Н2О2) -1, а в сполуках з фтором +2.
Ø ОКСИГЕН (КИСЕНЬ)
Найпоширеніший елемент на Землі; в повітрі - 21% (за об'ємом); в земній корі - 49% (за масою); в гідросфері - 89% за масою; у складі живих організмів - до 65% за масою.
Електронна будова атома
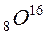 Заряд ядра 8
Заряд ядра 8
| 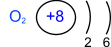
| р11 = 8; n01 = 8; ē = 8
|
| 1s2 2s22p4
| 
|
Оксиген проявляє переважно ступінь окиснення -2, але може мати і
-1, +1, +2.
| Ступені окиснення
| -2
| -1
(у пероксидах)
|
| +1
| +2
|
| (тільки зі фтором)
|
| Приклади сполук
| Н2О
вода
| Н2О2
Гідроген
пероксид
| О2
Кисень
| О2F2
| ОF2
|
| Фториди кисню
|
| Окисні властивості
| Тільки ВІДНОВНИК
| Окисно-відновна двоїстість
| Тільки ОКИСНИКИ
|
Існує увигляді двох простих речовин: О2 (кисень), О3 (озон).
| АЛОТРОПІЯ – це явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою.
|
· Кисень O2
| Фізичні властивості
| Кисень – безбарвний газ, без запаху, розчинний у воді.
|
| Хімічні
властивості
| Взаємодія речовин з киснем називається ОКИСНЕННЯМ
|
| З киснем реагують всі елементи (крім Au, Pt, He, Ne і Ar), у всіх реакціях (крім взаємодії з фтором) кисень - ОКИСНИК.
Реагує з:
|
| 1). неметалами
(утворює кислотні оксиди):
| 2). металами
(утворює основні оксиди):
| 3). складними речовинами:
|
| C + O2 ® CO2
S + O2 ®SO2
2H2 + O2 ® 2H2O
| 2Mg + O2 ®2MgO
2Cu + O2 –t ®2CuO
| 4FeS2 + 11O2®2Fe2O3 + 8SO2
2H2S + 3O2®2SO2 + 2H2O
CH4 + 2O2® CO2 + 2H2O
|
| Застосування
| Використання О2 базується на його окисних властивостях:
- є необхідним для життя (процеси дихання, горіння, іржавіння);
- бере участь в окисно відновних процесах;
- в медицині – для полегшення дихання хворих (кисневі подушки),
- для добування азотної (НNO3) та сірчаної (H2SO4) кислот;
- випалювання руд;
- у металургії для виробництва сталі;
- для зварювання і різання металів.
|
· Озон O3 - алотропна модифікація кисню
| Фізичні
властивості
| Озон – газ із характерним запахом, отруйний (N), добре розчинний у воді.
|
| Одержання
| Під час грози (в природі), (в лабораторії) в озонаторі: 3O2 D 2O3
|
| Хімічні
властивості
| Хімічно активний, окиснює навіть золото (до Au2O) та срібло
(до Ag2O).
|
| 1).Нестійкий:
O3 ® O2 + O
| 2).Сильний окисник:
2KI + O3 + H2O ® 2KOH + I2 + O2
(якісна реакція на озон)
|
| Знебарвлює фарбуючі речовини, відбиває УФ-промені, знищує мікроорганізми.
|
| Застосування
| - для озонування води;
- для знешкодження промислових стічних вод;
- для вибілювання тканин;
- як дезинфікуючий засіб;
- як окисник ракетного палива.
|
Ø Сірка (сульфур) S





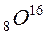 Заряд ядра 8
Заряд ядра 8