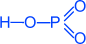Молекула полярна, має форму трикутної піраміди з атомом азоту у вершині. Атом азоту знаходиться в sp3- гібридному стані; з чотирьох гібридних орбіталей азоту три беруть участь в утворенні одинарних зв'язків N–H, а четвертий зв'язок зайнятий неподіленою електронною парою. 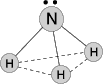
Фізичні властивості NH3 - безбарвний газ, запах різкий, задушливий, N отруйний, легший за повітря.
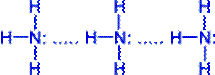
Молекули аміаку зв'язані слабкими водневими зв'язками
Хімічні властивості
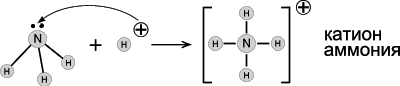
Утворює ковалентний зв'язок по донорно-акцепторному механізму.
| 1) Аміак - основа Льюїса. Його розчин у воді (аміачна вода) утворює гідроксид амонію NH4OH (рН> 7)
NH3 + Н2O ® NH4OH ®NH4+ + OH-
|
| 2) реагує з кислотами з утворенням солей амонію NH3 + HCl ® NH4Cl
|
| ВІДНОВНИК (окиснюється до N2+1O або N+2O)
|
| 1) Розклад при нагріванні: 2N-3H3 t ® N20 + 3H2
|
| 2) Горіння 4N-3H3 + 3O2 ® 2N20 + 6Н2O
|
· Солі амонію
Солі амонію – складні речовини, до складу яких входять катіони амонію NH4+, зв'язані з кислотним залишком.
Фізичні властивості. Кристалічніречовини, добре розчинні у воді.
Одержання Аміак (або гідроксид амонію) + кислота.
NH3 + HNO3 ® NH4NO3 (нітрат амонію)
2NH4OH + H2SO4 ® (NH4)2SO4(cульфат амонію) + 2Н2O
Хімічні властивості
| 1). Сильні електроліти (дисоціюють у водних розчинах)
| NH4Cl ® NH4+ + Cl-
|
| 2). Розкладання при нагріванні:
| NH4Cl t® NH3 + HCl
NH4HCO3 ® NH3 + Н2O + CO2
|
| 3). З кислотами і солями (реакція обміну)
a) (NH4)2CO3 + 2НCl ® 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- ® 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ ® Н2O + CO2
b) (NH4)2SO4 + Ba(NO3)2 ®BaSO4 + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- ® BaSO4¯ + 2NH4+ + 2NO3-
Ba2+ + SO42- ® BaSO4¯
|
| 4). Солі амонію піддаються гідролізу (як сіль слабкої основи і сильної кислоти) – середовище кисле (рН< 7):
| NH4Cl + Н2O® NH4OH + HCl
NH4+ + Н2O ® NH4OH + H+
|
| 5). При нагріванні з лугами виділяють аміак (якісна реакція на NH4+)
| NH4Cl + NaOH –t® NaCl + NH3 + Н2O
|
· ОКСИДИ НІТРОГЕНУ
| N2+1O
| N+2O
| N2+3O3
| N+4O2
| N2+5O5
|
| нітроген (I) оксид
| нітроген (II) оксид
| нітроген (III) оксид
| нітроген (IV) оксид
| нітроген (V) оксид
|
| Несолетворні оксиди
| Кислотні оксиди
|
· нітритна (азотиста) кислота HNO2 (H–O–N=O)
Слабка кислота; її солі нітрити – стійкі:
HNO2 + NaOH ® NaNO2 (натрій нітрит) + H2O
Хімічні властивості
| 1) Розкладається при нагріванні:
3HNO2 ® HNO3 + 2NO + H2O
|
| 2). Сильний ВІДНОВНИК:
HNO2 + Cl2 + H2O ® HNO3 + 2HCl
|
нітратна (азотна) кислота HNO3 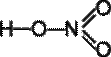 Н
Н
R Дуже сильна кислота. Солі – нітрати NaNO3 – натрій нітрат
Хімічні властивості
| 1) з основними оксидами: CuO + 2HNO3 ® Cu(NO3)2 + H2O
|
| 2) з основами: HNO3 + NaOH ® NaNO3 + H2O
|
| 3) витісняє слабкі кислоти з їх солей:
2HNO3 + Na2CO3 ®2NaNO3 + H2O + CO2
|
| R СИЛЬНИЙ ОКИСНИК
|
| Специфічні властивості
1) Розкладається на світлі і при нагріванні
4HNO3 –t, h® 2H2O + 4NO2 + O2
|
| 2). З неметалами: 3P0 + 5HNO3 + 2H2O ® 5 NO + 3H3P+5O4
S0 + 6HNO3(конц) ® H2S+6O4 + 6 NO2 + 2H2O
|
| 3) При взаємодії з металами (!) ніколи не виділяє Н2:
метал + HNO3 ® сіль азотної кислоти + вода + газ
|
|
| HNO3
|
|
|
| ¯
|
|
| ¯
|
|
| КОНЦЕНТРОВАНА
| РОЗВЕДЕНА
|
| ¯
| ¯
| ¯
| ¯
| ¯
|
| Fe, Al, Cr, Au, Pt пасивує
(без нагрівання)
| з важкими металами NO2
| з лужними і лужноземельними металами N2O
| з важкими металами NO
| з лужними і лужноземельними металами, а також Sn і Fe NH3 (NH4NO3)
|
| | | | | | | | | | | | | | | | | |
| HNO3 + 4HCl
| + Au ® H[AuCl4] + NO + 2H2O
|
| " царська водка" (1: 3 по об’єму)
|
|
Реакції розкладання нітратів при нагріванні
| 1) Нітрати лужних металів
(від Li до Na) розкладаються до нітриту:
| 2NaNO3 –t® 2 NaNO2 + O2
|
| 2) Нітрати менш активних металів
(від Mg до Cu) розкладаються до оксидів:
| 2Mg(NO3)2 –t® 2 MgO + 4NO2 + O2
2Cu(NO3)2 –t® 2 CuO + 4NO2 + O2
|
| 3) Нітрати найменше активних металів (правіше від Cu в електрохімічному ряді) розкладаються до металів:
| Hg(NO3)2 –t® Hg + 2NO2 + O2
2AgNO3 –t® 2 Ag + 2NO2 + O2
|
| 4) Нітрат амонію розкладаються до N2O
| NH4NO3 –t® N2O + 2H2O
|
Ø ФОСФОР.
Будова атома, властивості фосфору та основних його сполук
Алотропні модифікації
· Білий фосфор. Виходить при конденсації пари. Складається з молекул P4. М'яка, безбарвна речовина, отруйний. Дуже реакційноздатний, окиснюється на повітрі (при цьому займається), в темряві світиться.
· Червоний фосфор. Без запаху, колір червоно-бурий, не отруйний. Нерозчинний у воді і в органічних розчинниках. Стійкий. В темряві не світиться.
· Чорний фосфор - полімерна речовина з металевим блиском, схожий на графіт, без запаху, жирний на дотик. Нерозчинний у воді і в органічних розчинниках.
Хімічні властивості
| ВІДНОВНИК
|
| 1) з киснем: 4P0 + 5O2 –t® 2P2+5O5
(при недостачі кисню 4P0 + 3O2 –t ® 2P2+3O3)
|
| 2) з галогенами і сіркою: 2P + 3Cl2® 2PCl3 2P + 5Cl2 ® 2PCl5 2P + 5S –t ® P2S5
(галогеніди фосфору легко розкладаються водою, наприклад:
PCl3 + 3H2O® H3PO3 + 3HCl PCl5 + 4H2O ® H3PO4 + 5HCl)
|
| 3) з азотною кислотою: 2HNO3 + Na2CO3 ®2NaNO3 + H2O + CO2
|
| ОКИСНИК
|
| 4) з металами утворює фосфіди, в яких фосфор проявляє ступінь окиснення, - 3:
2P0 + 3Mg® Mg3P2-3; 3Li + P ® Li3P-3
(фосфід магнію легко розкладається водою
Mg3P2 + 6H2O ® 3Mg(OH)2 + 2PH3(фосфін))
|
| РЕАКЦІЯ ДИСПРОПОРЦІОНУВАННЯ
|
| 5) з лугом: 4P0 + 3NaOH + 3H2O ®P-3H3 + 3NaH2P+3O3
|
·Фосфористий ангідрид, оксид фосфору (III) – P2+3O3
Одержання. Окиснення фосфору при недостачі кисню
4P + 3O2 ® 2P2O3
Хімічні властивості
| 1) Всі властивості кислотних оксидів: P2O3 + 3H2O ®2H3PO3
|
| 2) Сильний ВІДНОВНИК: O2 + P2+3O3 ® P2+5O5
|
· Фосфорний ангідрид, оксид фосфору (V) – P2+5O5
Хімічні властивості
| Всі хімічні властивості кислотних оксидів, реагує
1) з водою P2O5 + H2O® 2HPO3 (метафосфатна кислота)
P2O5 + 2H2O ® H4P2O7 (пірофосфатна кислота)
P2O5 + 3H2O ® 2H3PO4 (ортофосфатна кислота)
|
| 2) з основними оксидами P2O5 + 3BaO® Ba3(PO4)2
|
| 3) з лугами P2O5 + 6KOH ®2K3PO4+ 3H2O
|
| 4) P2O5 - сильний водовіднімаючий засіб: P2O5+ 2HNO3 ® 2HPO3 + N2O5
P2O5+ 2HClO4 ®2HPO3+ Cl2O7
|
·Метафосфорна кислота – HP+5O3 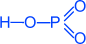
Солі метафосфорної кислоти - мета фосфати (KPO3 – мета фосфат калію)
Одержання P2O5+ H2O ® 2HPO3
Хімічні властивості Характерні всі властивості кислот
·Фосфорна кислота – H3P+5O3 Фосфориста кислота 
Хімічні властивості
| 1) Водний розчин H3PO3 - двохосновна кислота середньої сили (солі – фосфІТИ):
H3PO3+ 2NaOH ® Na2HPO3+ 2H2O
|
| 2) При нагріванні перетворюється в ортофосфорну кислоту і фосфін:
4H3PO3 ® 3H3PO4+ PH3
|
| 3) Відновні властивості: H3PO3+ HgCl2+ H2O ®H3PO4+ Hg + 2HCl
|
·Ортофосфорна кислота - H3P+5O4 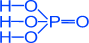
Ортофосфорна кислота – середньої сили, не є окисником, трьохосновна. Вона утворює середні солі - ортофосфати (Na3PO4) і два типи кислих солей - дигідро фосфати (NaH2PO4) і гідро фосфати (Na2HPO4).
Хімічні властивості
| Для ортофосфорної кислоти характерні всі властивості кислот – неокисників. При нагріванні вона перетворюється на пірофосфорну кислоту
2H3PO4 –t® H4P2O7 + H2O
|
| þ Якісна реакція на аніониPO43-
3Ag+ + PO43- ® Ag3PO4¯ (яскраво-жовтий осад)
|




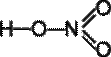 Н
Н