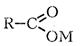ЗАНЯТТЯ №36
Тема: Контрольна робота №4 Актуальність теми: Хімічні властивості елемента – здатність вступати в хімічні реакції, утворювати ті чи інші сполуки визначається його місцем в періодичній системі. Елементи утворюють хімічні сполуки. Знання властивостей елемента дозволяє передбачити властивості сполук, які він утворює. Навчальні цілі: Знати: розташування елементів в періодичній системі, особливості їх електронної будови, валентності та ступені окислення елементів, їх фізичні та хімічні властивості, біологічну роль. Уміти: характеризувати елемент за положенням в періодичній системі, визначати його валентність і ступінь окиснення, визначати електронну формулу елементу, складати рівняння хімічних реакцій, в тому числі окисно-відновних, визначати окисник і відновник. Самостійна позааудиторна робота студентів. 1) Повторити матеріал за заняття №№ 26-35. 2) Готувати відповіді на наступні контрольні питання. Контрольніпитання 1. Де в періодичній системі хімічних елементів знаходяться метали, неметали, амфотерні елементи? 2. Як називаються елементи головних підгруп I, II, VI, VII, VIII груп? 3. Які хімічні властивості проявляють метали. 4. Як визначити активність металів за їх положенням в періодичній системі хімічних елементів? 5. Що таке електрохімічний ряд напруг металів? 6. Які фізичні властивості металів? 7. Як впливає ступінь окислення d-елементів на кислотність чи основність їх сполук? 8. Що таке сплави? 9. Які хімічні властивості характерні для неметалів? 10. Які фізичні властивості проявляють неметали? 11. Що таке алотропія? 12. Що таке окиснення та відновлення? 13. Які елементи можуть бути окисниками та відновниками? 14. Які хімічні властивості характерні для амфотерних елементів? 15. Що таке твердість води? Види твердості води.
Самостійна робота на занятті Кожний студент отримує індивідуальне завдання і розв’язує його на занятті. Приклади завдань, що виносяться на контрольну роботу: 1. Закінчити рівняння можливих реакцій. Назвати одержані сполуки: Fe + Сl2 →; N2 + O2 →; Cu + HCl →; Mg + H2O →; Mg + CaCl2 →; NaOH + Zn(OH)2 →; 2. Скласти рівняння реакцій за схемою: K → K2SO4 → K2O → KOH; 3. Суміш порошків магнію та літій оксиду масою 16, 4 г розчинили в хлоридній кислоті. Одержали сіль магній хлорид масою 3, 6 г. Знайти масову частку оксиду літію в суміші. 4. Продовжити окисно-відновне рівняння, скласти електронний баланс, поставити коефіцієнти реакції, визначити відновник і окисник: Cu + HNO3 (конц) →
Частина ІІІ. ОРГАНІЧНА ХІМІЯ Розділ 11. ТЕОРЕТИЧНІ ОСНОВИ ОРГАНІЧНОЇ ХІМІЇ §11.1. Предмет органічної хімії
Органічна хімія відіграє велику роль в житті людини: ·органічні реакції протікають в клітинах і тканинах людини (метаболізм, травлення, скорочення м’язів і інш.); ·виробництво лікарств, барвників, гуми, пластмас і т.д. §11.2. Теорія будови органічних речовин. Ізомери. Теорія будови органічних сполук А.М. Бутлерова: На відміну від неорганічних речовин, органічні речовини мають декілька загальних характерних особливостей в будові. Ці особливості показав в своїй теорії відомий російський вчений А.М. Бутлеров: 1. Атоми в молекулах органічних сполук пов'язані один з одним в певному порядку відповідно до їх валентності.
þ Атом Карбону в молекулах органічних сполук є 4-х валентним. 2. Атоми, зв’язані в молекулу, впливають один на одного і на реакційну здатність молекули. 3. Властивості органічних речовин залежать не тільки від їх якісного та кількісного складу, але і від будови їх молекул. Наприклад, формулі речовини С2Н6О відповідають дві різні сполуки: диметиловий етер (СН3-О-СН3) і етанол (С2Н5-ОН). В цьому прикладі дві речовини мають однакову молекулярну формулу С2Н6О, але різну будову молекул і різні властивості. Такі речовини (СН3-О-СН3 і С2Н5-ОН) називаються ізомерами. Інший приклад: формулі С4Н10 відповідають дві органічні речовини різної будови:
Отже, н- бутан та 2 – метилпропан також є ізомерами.
§11.3. Класифікація органічних сполук Для класифікації органічних сполук прийнято виділяти вуглецевий скелет (головна частина молекули) і функціональні групи, які визначають властивості даної речовини. Вуглецевий скелет – послідовне сполучення між собою атомів вуглецю в молекулі. Вуглецевий скелет часто називають вуглецевим ланцюгом. Функціональна група – атом або група атомів, що показує належність сполук до класів органічних сполук і визначає їх найголовніші хімічні властивості. Атоми водню, зв’язані з вуглецевим ланцюгом не є функціональними групами. Всі органічні сполуки можна розділити на ациклічні (нециклічні або ланцюгові) і циклічні. Ациклічні сполуки мають розімкнутий вуглецевий ланцюг. Циклічні сполуки мають замкнутий вуглецевий ланцюг. Класифікацію органічних сполук можна представити у вигляді схеми:
§11.4. Основні класи органічних сполук Наявність функціональних груп, які визначають основні властивості органічних речовин, дозволяє розділити ці речовини на класи:
Всі класи органічних сполук взаємозв'язані. Перехід від одних класів сполук до інших здійснюється в основному за рахунок перетворень функціональних груп без зміни вуглецевого скелету.
§11.5. Номенклатура органічних сполук
Є три види номенклатур: 1) тривіальна; 2) раціональна; 3) систематична або міжнародна (IUPAC). 1. Тривіальна (емпірична) назва, яка надавалася сполукам згідно з: а) природним джерелом одержання (яблучна, молочна, бурштинова кислоти, сечовина); б) методом одержання: піровиноградна кислота, яку добували піролізом; в) ім'ям першовідкривача (реактив Гріньяра, спирти Фаворського, кетон Міхлера). 2. Раціональна – враховує будову сполук. В її основу покладено поділ органічних сполук на певні класи у вигляді гомологічних рядів. Наприклад, для насичених вуглеводнів:
Для ненасичених вуглеводнів:
Однак, для утворення назв складніших сполук раціональна номенклатура непридатна і тепер не рекомендована. 3. Систематична-(IUPAC*) номенклатура утворює найбільш правильні назви. *(IUPAC)- міжнародна спілка теоретичної і практичної хімії. Номенклатура IUPAC допускає декілька варіантів утворення назв органічних сполук, з яких найбільшої уваги заслуговують замісникова та раціонально-функціональна номенклатура. Замісникова номенклатура IUPAC використовується при заміні атома або атомів водню у головній структурі найпростіших вуглеводнів іншими залишками або функціональними групами, які називаються замісниками. При складанні назв необхідно визначити всі функціональні групи, що входять до складу сполуки, і вибрати серед них головну(старшу). У табл. 3.1 наведені функціональні групи, які розташовані за порядком зменшення старшинства. Головна група при цьому позначається в суфіксі, а решта- в префіксі. За правилами IUPAC деякі другорядні функціональні групи завжди позначаються в префіксі (табл. 2). Вважають, що такі сполуки, як вуглеводні галагенопохідні, етери, тіоетери, нітро- і нітрозосполуки, азосполуки, діалкілпероксиди, не відносяться до головних функціональних груп. Послідовність складання назви включає: 1) визначення головної (старшої) функціональної групи; 2) вибір родоначальної структури (найдовший вуглецевий ланцюг); 3) нумерація родоначальної структури (ланцюг нумерують, починаючи з того кінця, до якого ближче функціональна група, кратний зв'язок або розгалуження); 4) послідовність складання назви в загальному вигляді: Назва = префікс + корінь + суфікс Приклади:
Таблиця 11.1. Головні функціональні групи у замісниковій номенклатурі та їх позначення за порядком зменшення старшинства
** атом вуглецю, що в дужках, при нумерації входить до головного вуглецевого скелета.
Таблиця 3.2. Другорядні групи у замісниковій номенклатурі, які вказуються лише у префіксі (за алфавітом)
§11.6. Класифікація реакцій в органічній хімії Органічні сполуки здатні до різних хімічних перетворень, які можуть проходити як без зміни вуглецевого скелету, так і з таким. Більшість реакцій проходить без зміни вуглецевого скелету. 1) заміщення (S): RH + Br2 ® RBr + HBr 2) приєднання (A): CH2=CH2 + Br2 ® CH2Br – CH2Br 3) відщеплення (E): CH3–CH2–Cl ® CH2=CH2 + HCl
Реакції заміщення характерні для всіх класів органічних сполук. Заміщатися можуть атоми водню або атоми будь-якого іншого елементу, окрім карбону. Реакції приєднання характерні для сполук з кратними зв'язками (=, º), які можуть бути між атомами вуглецю, вуглецю і кисню, вуглецю і азоту і т. д., а також для сполук, що містять атоми з вільними електронними парами або вакантними орбіталями. До реакцій відщеплення здатні сполуки, що містять електронегативні групи. Легко відщеплюються такі речовини, як вода, галогеноводні, аміак.
Розділ 12. ВУГЛЕВОДНІ
Вуглеводні поділяють на: · насичені - алкани · ненасичені – алкени, алкіни, алкадієни.
§12.1. Насичені вуглеводні (АЛКАНИ)
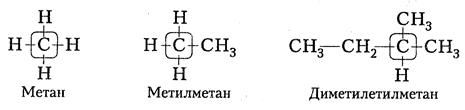
Загальна формула алканів CnH2n+2. Назви алканів утворилися від грецьких і латинських числівників з додаванням суфікса –ан. Найпростішим насиченим вуглеводнем є Мет ан:
12.1.1. Гомологічний ряд алканів Алкани утворюють гомологічний ряд. Перший член гомологічного ряду – метан (СН4), тому алкани називають гомологами метану. Гомологи – це речовини, які мають однакову будову, але відрізняються один від одного на одну або декілька груп -СН2- (голологічна різниця).
Якщо у молекули вуглеводню відняти один атом водню, то одержимо один одновалентний залишок – радикал (алкіл). Назви радикалів утворюються від назв відповідних вуглеводнів з заміною суфікса –ан на –ил (іл.). Наприклад: метан СН4 мет ил СН3- пропан С3Н8 проп іл С3Н7-.
|

 - пропаналь (альдегід),
- пропаналь (альдегід),  - пропанон (ацетон).
- пропанон (ацетон).
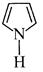
 фуран пірол тіофен
фуран пірол тіофен
 циклобутан
циклобутан
 бензен
бензен


 етаналь
етаналь

 ацетон
ацетон


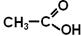 етанова кислота
етанова кислота

 метиловий естер оцтової кислоти
метиловий естер оцтової кислоти