Одержання. 1) з природної сировини (нафти, природного газу, вугілля)
1) з природної сировини (нафти, природного газу, вугілля). Нафта – це складна суміш органічних сполук, основними компонентами якої є нерозгалужені та розгалужені алкани. Природний газ складається з газоподібних алканів, головним чином метану (до 95%), етану, пропану і бутану. Для одержання з нафти суміші алканів та інших вуглеводнів її піддають фракційній перегонці. 2) гідрування ненасичених або циклічних вуглеводнів у присутності каталізаторів (платини, паладію, нікелю): CH3–CH=CH– CH3 + H2 − Ni g CH3–CH2–CH2–CH3 бутен-2 бутан 3) реакція Вюрца: 2CH3–CH2Br + 2Na Ò CH3–CH2–CH2–CH3 + 2NaBr бромистий етил бутан Метан одержують 4) відновленням вуглецю і його оксидів воднем: С + 2Н2 − t°, Ni g CH4 СО + 3Н2 = СН4 + Н2О СО2 + 4Н2 = СН4 + 2Н2О 5) сплавленням солей карбонових кислот з лугами: CH3COONa + NaOH Ò CH4 + Na2CO3 натрій ацетат метан натрій карбонат 6) дією води на карбід алюмінію: Al4C3 + 12H2O Ò 3 CH4 + 4Al(OH)3
12.1.5. Фізичні властивості У звичайних умовах перші чотири алкани – гази, C5–C17 – рідини, а починаючи з C18 – тверді речовини. Таким чином, із збільшенням молекулярної маси підвищується густина алканів, збільшується температура плавлення і кипіння. Всі алкани легші за воду, в ній не розчиняються, але розчиняються в органічних розчинниках. 12.1.6. Хімічні властивості Оскільки зв’язки С-Н в насичених вуглеводнях міцні, їх важко розірвати, то для алканів найбільш характерні реакції заміщення водневих атомів, а також реакції розщеплення С-С зв’язку, окиснення та ізомеризації. · Реакції заміщення: 1) галогенування. Алкани легко реагують з галогенами, крім йоду. Реакція проходить при УФ-опроміненні або нагріванні (300°С) за ланцюговим вільнорадикальним механізмом. CH4 + Сl2 − һ ν g CH3Сl + HСl хлорметан CH3Сl + Сl2 − һ ν g CH2Сl2 + HСl дихлорметан CH2Сl2 + Сl2 − һ ν g CHСl3 + HСl трихлорметан CHСl3 + Сl2 − һ ν g CСl4 + HСl тетрахлорметан Тетрахлорметан – продукт повного хлорування метану (всі чотири атоми водню замістилися на атоми хлору. У ланцюговому процесі виділяють три стадії:
2) нітрування (реакція Коновалова). Під дією розбавленої нітратної кислоти атоми водню в алканах заміщаються на нітрогрупу: C3H7− Н + НО− NO2 g C3H7− NO2 + H2O пропан нітропропан Реакції відщеплення: 3) крекінг – розпад алканів при високій температурі та присутності каталізаторів (утворюються насичені і ненасичені вуглеводні з більш короткими ланцюгами). CH3–CH2–CH2–CH3 − 400° g CH3–CH3 + CH2=CH2 бутан етан етилен 2CH4 − 1500° g H–C≡ C–H + 3H2 метан ацетилен 4) дегідрогенізація – реакція відщеплення водню від молекули органічної сполуки в присутності каталізатора, що веде до утворення подвійного або потрійного зв’язку: CH3–CH2–CH2–CH3 − t°, кат g CH3–CH=CH–CH3+Н2 бут ан бут ен · Реакції окиснення: В звичних умовах алкани стійкі до дії кисню і окисників. 5) горіння на повітрі CH4 + 2O2 − полум’я g CO2 + 2H2O, ∆ Н = -890 кДж/моль вуглекислий вода газ Реакція проходить з виділенням великої кількості тепла. CH4 + O2 − t° g CO + 2H2O чадний газ вода (! отрута N)
6) ізомеризація. При нагріванні в присутності каталізаторів у вуглеводнях нормальної будови відбувається перебудова вуглецевого скелету з утворенням алканів розгалуженої будови:
12.1.7. Застосування Алкани застосовують в основному як паливо (метан, пропан, бутан), а також для виробництва пластмас, лаків, розчинників. Ізомери алканів застосовуються для виробництва бензинів та каучуків. Вазелінове масло – безбарвна масляниста рідина без запаху і смаку. За хімічною структурою являє собою суміш алканів з числом вуглецевих атомів до 15. Використовується в медицині як проносний засіб, у фармації при виготовленні лікарських форм та в парфюмерно-косметичній промисловості. Вазелін – безбарвна або світло-жовтого кольору однорідна речовина, практично нерозчинна у воді. У хімічному відношенні являє собою суміш рідких і твердих алканів з числом атомів карбону від 12 до 25. У фармації широко використовується для виготовлення мазей. Парафін складається із суміші твердих алканів з числом вуглецевих атомів від 19 до 35. Застосовується у фармації як основа для виготовлення мазей. У зв’язку з великою теплоємністю і низькою теплопровідністю парафін використовують у медицині для лікування теплом (парафінотерапія). Озокерит (гірський віск) – тверда воскоподібна маса чорного кольору. Це викопна речовина нафтового походження. За хімічною структурою являє собою суміш вищих алканів і алкенів, смол і мінеральних масел. Як і парафін, озокерит застосовують у медицині для лікування теплом при невралгія, невритах, плекситах та інших захворюваннях. §12.2. Ненасичені вуглеводні До ненасичених сполук відносять алкени (олефіни, або етиленові вуглеводні), дієнові вуглеводні (алкадієни) та алкіни (ацетиленові вуглеводні). Всі ці сполуки містять подвійні або потрійні вуглець-вуглецеві зв’язки.
12.2.1. Алкени. Гомологічний ряд алкенів.
Загальна формула алкенів CnH2n. Назви алкенів утворені від грецьких і латинських числівників з додаванням суфікса –ен. Алкени утворюютьгомологічний ряд. Першийнайпростіший ненасичений вуглеводень є Етил ен ( ет ен):
12.2.2. Електронна будова подвійного зв’язку Розглянемо будову молекули етилену С2Н4 (СН2=СН2): у кожного атома вуглецю стають гібридними 3 електронні орбіталі, утворені 1s- і 2р - електронами (sp2- гібридизація). Гібридні орбіталі утворюють s - зв’язки з атомами водню і між атомами вуглецю. Негібридні орбіталі (р - електрони) утворюють π -зв’язок між атомами вуглецю, вони знаходяться в площині, перпендикулярній площині розміщення s - зв’язків.
Рис.3. Утворення подвійного зв’язку в молекулі етилену
12.2.3. Ізомерія Для алкенів характерні два види ізомерії: структурна і просторова. Структурні ізомери – це ізомери, що мають різний порядок сполучення атомів у молекулі і різні структурні формули. Розрізняють ізомерію вуглецевого скелету та положення кратного зв’язку:
Цис –означає, що замісники знаходяться по одну сторону молекули, транс – замісники знаходяться по різні сторони молекули. Замісники – це групи, які заміщені на атоми водню у молекулі.
|


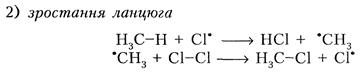

 пентан
пентан
 2- метилбутан
2- метилбутан




 цис-ізомер
цис-ізомер
 транс-ізомер
транс-ізомер



