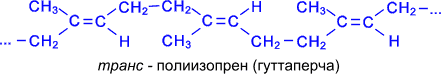Застосування. Етилен СН2=СН2 – безбарвний газ з дуже слабким запахом, малорозчинний у воді, з повітрям утворює вибухові суміші
Етилен СН2=СН2 – безбарвний газ з дуже слабким запахом, малорозчинний у воді, з повітрям утворює вибухові суміші, горить кіптявим полум’ям. Служить сировиною в промисловості для добування етанолу, етиленгліколю, оцтового альдегіду, поліетилену та ін. Пропілен СН2=СН-СН3 – безбарвний газ зі слабким запахом. Широко використовується в промисловому органічному синтезу для добування ізопропілового спирту, гліцерину, ацетону, поліпропілену, та інших цінних органічних продуктів. 12.2.8. Дієнові вуглеводні (алкадієни). Типи алкадієнів.
Загальна формула алкадієнів CnH2n-2. Назви алкадієнів утворені від грецьких і латинських числівників з додаванням суфікса – дієн. Залежно від взаємного розташування подвійних зв'язків дієни поділяються на три типи: 1) вуглеводні з кумульованими подвійними зв'язками, тобто примикаючими до одного атома вуглецю. Наприклад, пропадієн CH2=C=CH2; 2) вуглеводні з ізольованими подвійними зв'язками, тобто розділеними двома і більш простими зв'язками. Наприклад, пентадієн -1, 4 CH2=CH–CH2–CH=CH2; 3) вуглеводні із зв'язаними (спряженими) подвійними зв'язками, тобто розділеними одним простим зв'язком. Наприклад, бутадієн -1, 3 CH2=CH–CH=CH2 Найбільший інтерес представляють вуглеводні із зв'язаними подвійними зв'язками. 12.2.9. Одержання алкадієнів Вуглеводні із зв'язаними подвійними зв'язками одержують: 1) дегідруванням алканів, що містяться в природному газі і газах нафтопереробки, при пропусканні їх над нагрітим каталізатором: CH3–CH2–CH2–CH3 –– ~600°С; Cr2O3, Al2O3 ® CH2=CH–CH=CH2 + 2H2 бутан бутадієн-1, 3
2) дегідруванням і дегідратацією етилового спирту при пропусканні пари спирту над нагрітими каталізаторами (метод акад. С.В.Лебедєва) 2CH3CH2OH –– ~450°С; ZnO, Al2O3 ® CH2=CH–CH=CH2 + 2H2O + H2 етанол бутадієн-1, 3 12.2.10. Хімічні властивості алкадієнів Атоми вуглецю в молекулі бутадієну знаходяться в sp2 – гібридному стані, що означає розташування цих атомів в одній площині і наявність біля кожного з них однієї p-орбіталі, зайнятої одним електроном і розташованої перпендикулярно до згаданої площини.
p - Орбіталі всіх атомів вуглецю перекриваються один з одним, тобто не тільки між першим і другим, третім і четвертим атомами, але і також між другим і третім. Звідси видно, що зв'язок між другим і третім атомами вуглецю не є простим s- зв'язком, а володіє деякою густиною p- електронів, тобто слабким характером подвійного зв'язку. Це означає, що s- електрони не належать строго певним парам атомів вуглецю. В молекулі відсутні в класичному розумінні одинарні і подвійні зв'язки, а спостерігається делокалізація р- електронів, тобто рівномірний розподіл p- електронної густини по всій молекулі з утворенням єдиної p- електронної хмари. Таким чином, молекула бутадiєну-1, 3 характеризується системою зв'язаних подвійних зв'язків. Така особливість в будові дієнових вуглеводнів робить їх здатними приєднувати різні реагенти не тільки до сусідніх вуглецевих атомів (1, 2- приєднання), але і до двох кінців зв'язаної системи (1, 4- приєднання) з утворенням подвійного зв'язку між другим і третім вуглецевими атомами. Відзначимо, що дуже часто продукт 1, 4- приєднання є основним. Розглянемо реакції галогенування і гідрогалогенування зв'язаних дієнів.
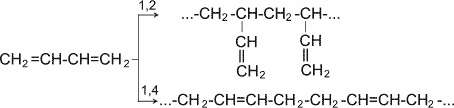
Як видно, реакції бромування і гідрохлорування призводять до продуктів 1, 2- і 1, 4- приєднання, причому кількість останніх залежить, зокрема, від природи реагенту і умов проведення реакції. Важливою особливістю зв'язаних дієнових вуглеводнів є, крім того, їх здатність вступати в реакцію полімеризації. Полімеризація, як і у олефінів, здійснюється під впливом каталізаторів або ініціаторів. Вона може протікати по схемах 1, 2- і 1, 4- приєднання.
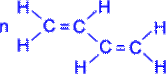
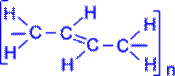
Полімеризація дієнових сполук У спрощеному вигляді реакцію полімеризації бутадієну -1, 3 по схемі 1, 4 приєднання можна представити таким чином:
У полімеризації беруть участь обидва подвійні зв'язки дієну. В процесі реакції вони розриваються, пари електронів, створюючі s- зв'язки роз'єднуються, після чого кожний неспарений електрон бере участь в утворенні нових зв'язків: електрони другого і третього вуглецевих атомів в результаті узагальнення дають подвійний зв'язок, а електрони крайніх в ланцюзі вуглецевих атомів при узагальненні з електронами відповідних атомів іншої молекули мономера зв'язують мономери в полімерний ланцюжок.
У вільному стані дієнові вуглеводні не існують, але вони входять до складу полімерів природніх канчуків. Натуральний каучук одержують із соку (латекса) каучуконосного дерева гевеї (тропічні ліси Бразилії).
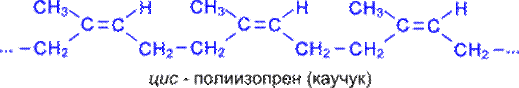
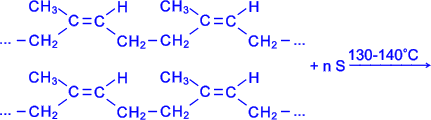
Синтетичний бутадієновий каучук вперше отриманий російським хіміком Лєбєдєвим в 1932 р. полімеризацією дивінілу
Атоми сірки приєднуються по місцю розриву деяких подвійних зв'язків і лінійні молекули каучуку " зшиваються" в більш крупні тривимірні молекули - виходить гума, яка по міцності значно перевершує невулканізований каучук. Наповнені активною сажею каучуки у вигляді гум використовують для виготовлення автомобільних шин і інших гумових виробів.
12.2.11. Алкіни. Гомологічний ряд алкінів
Загальна формула алкінів CnH2n-2. Назви алкінів походять від грецьких та латинських числівників з додаванням суфікса – ін (-ин). Алкіни утворюють гомологічний ряд. Перший член гомологічного ряду алкінів – етин С2Н2 HC≡ CH (традиційна назва ацетилен, тому алкінові вуглеводні називають ще ацетиленовими).
|

 a)
a)
 б)
б)
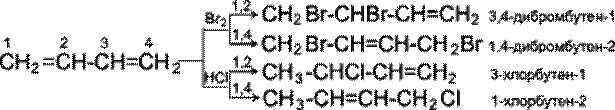
 .
.