Работа и теплота. Свойства работы и теплоты.
Введем обозначения: A – абсолютная работа, Q – теплота. Различают не только механическую(деформационную), но и немеханическую(например: работа химических реакций, работа электрических и магнитных сил). Примечание: в дальнейшем, во всех формулах термодинамики используются удельные величины, то есть величины отнесенные у 1 кг системы, при этом размерность А[ Как было установлено в ходе развития науки, работа и теплота- это единственные формы передачи энергии, то есть работа и теплота проявляются только в процессе передачи энергии, поэтому термины «механическая энергия», «тепловая энергия» не являются точными. Как было показано ранее внутренняя энергия системы U является ожнозначной функцией всей совокупности координат состояния системы, то есть: U = U(x1, x2,…,xn) (17) Если бы условие (17) не выполнилось, то стал бы возможным вечный двигатель первого рода, то есть двигатель, творящий работу без подвода энергии извне. Внутренняя энергия является функцией состояния, то есть ее изменение при переходе из начального состояния в конечное не зависит от пути перехода и определяется как разность значений в этих состояниях. DU = U2 – U1. Ранее было получено первое начало термодинамики в общем виде
Qk- общее обозначение количества воздействия при k-том взаимодействии Исходя из того, что единственным источником теплоты является внутренняя энергия системы (U), то выделим в правой части уравнения (1) отдельное слагаемое, соответствующее тепловому взаимодействию:
Как известно, для всех взаимодействий, кроме теплового, справедливо следующее выражение: dAk = –dQk, где Ak – работа при k-том взаимодействии (механическая и немеханическая).
Обозначим dU = dQ – dA (18) формула (18)- это первое начало термодинамики в обычной форме. Или dQ = dU + dA (18*) После интегрирования, уравнение (18*) запишется следующим образом: Q=∆U+A (19) Из уравнения (19)следует простоя формулировка первого закона термодинамики: подведённая к системе теплота идёт на изменение внутренней энергии системы и на совершение системой работы против внешних сил. Правило знаков для работы: Работа считается положительной, если она совершается против внешних сил (например, работа расширения) и работа считается отрицательной, если работа ведется над системой (работа сжатия). Теплота и работа, в отличие от внутренней работы, не являются функциями состояния, а являются функциями процесса. Этот тезис иллюстрируется следующими графиками:
P P 1 1
V1 V2 V S1 S2 S
Как будет показано далее Амех= Q= Из (20) следует, что графически, работа процесса в координатах PV изображается как площадь под кривой процесса. Из уравнения (21) следует, что теплота которой обмениваются система и окружающая среда в процессах TS координатах изображается в TS координатах как площадь под кривой процесса. Цикл- это круговой процесс, в котором система возвращается в исходное состояние. Например:
Циклы происходящие по часовой стрелке- прямые, против часовой стрелки- обратные. Так как внутренняя энергия U является функцией состояния, то ее изменение в этом цикле DU1-а-2-б-1=0 или
Из математики известно, что
Пример (из другой области):Eпот=mgH – независима от пути подъёма груза на высоту H. Исследование принадлежности A и Q к функциям состояния проще всего провести на примере деформационной системы:
1) оба интеграла имеют нулевые значения; 2) иначе, Деформационная система имеет одну степень свободы. Рассмотрим произвольный процесс, который совершает система:
dQдеф = - P dv dQk = - dAk dAдеф = P dv
Так как работа A и теплота Q не являются функциями состояния, то круговой интеграл
|

 ], Q[
], Q[  (1)
(1) .
. .
. , тогда
, тогда (20)
(20) (21)
(21)
 (22)
(22) .
.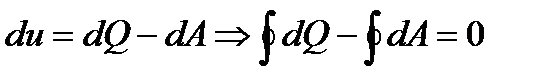 , поэтому на поставленный вопрос существует два возможных ответа:
, поэтому на поставленный вопрос существует два возможных ответа: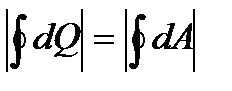 .
.


 , т.е.
, т.е.  .
. ,
,  , то есть dA и dQ не являются полными дифференциалами, и этот факт иногда отражают обозначениями вида đA,đQ.
, то есть dA и dQ не являются полными дифференциалами, и этот факт иногда отражают обозначениями вида đA,đQ.


