Уравнение состояния идеального газа. Из рис. 2.2 и 2.3 следует, что формулы, выражающие соответствующие законы, упростятся, если перенести начало координат в точку с температурой –273º С
Из рис. 2.2 и 2.3 следует, что формулы, выражающие соответствующие законы, упростятся, если перенести начало координат в точку с температурой –273º С. Для этого введем новую шкалу температур и будем обозначать новую температуру Т, величину градуса оставим той же, что и в шкале Цельсия. Тогда
отсюда
Запишем закон Шарля:
Аналогично для закона Гей-Люссака:
Температура, введенная таким образом, называется абсолютной, а соответствующая температурная шкала – шкалой Кельвина, предложившего ее в 1848 г. Из (2.1) и (2.2) при Т = 0 получается р = 0 и V = 0, чего, конечно, быть не может. Это неожиданное следствие получилось в результате применения рассмотренных законов для очень низких температур. Конечно, всякий реальный газ превратится в жидкость и затвердеет, прежде чем будет достигнута температура t = –273º C. Всякий физический закон имеет свои пределы применения. Чтобы получить уравнение состояния идеального газа, рассмотрим некоторую массу газа m, которая занимает объем V 1, имеет давление P 1 и находится при температуре T 1. Пусть эта же масса газа в другом состоянии имеет объем V 2, давление P 2 и температуру T 2. Перевести этот газ в другое состояние легко, если он находится в цилиндре под поршнем. Сначала, не меняя давление P 1, нагреем газ до температуры T 2, тогда он займет объем V' и этот объем по формуле (2.2) будет
Для того чтобы перевести его в окончательное состояние
Теперь подставим значение объема V' из (2.3):
или
Полученное для данной массы m соотношение указывает, что для любых двух состояний величина Обозначим это так:
Это соотношение было получено французским инженером Клапейроном в 1834 г. Конечно, для другой массы газа постоянная величина В имеет другое значение. Менделеев преобразовал уравнение Клапейрона, использовав закон Авогадро. Согласно этому закону при одинаковых давлениях и температурах объемы одного моля всех газов одинаковы. Таким образом, если
то
где В частности, при нормальных условиях, т.е. при Если соотношение (2.4) относить к одному молю, то постоянная В будет одинакова для любого газа. Обозначая ее через R, получим:
Однако теперь в этой формуле Итак,
Это и есть уравнение состояния для определенной массы, именно для одного моля. В такой форме оно было получено Менделеевым в 1875 г. и называется уравнением Клапейрона-Менделеева. Постоянная R называется универсальной газовой постоянной и является одной из основных физических констант. Вычислим ее значение. Для этого рассмотрим 1 моль газа при нормальных условиях.
Обобщим уравнение Клапейрона-Менделеева для произвольной массы идеального газа. Пусть газ с молярной массой μ взят в произвольном количестве, т.е. его масса m, а объем равен V. Величина
Отсюда следует, что для массы m выражение
или
Эта формула связывает все четыре величины и употребляется во всех случаях, когда приходится иметь дело с газами.
|

 .
.
 ,
, 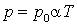 .
.
 .
.
 .
.
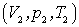 , проведем изотермическое изменение объема, для которого
, проведем изотермическое изменение объема, для которого .
.
 .
.
 .
.
 остается неизменной.
остается неизменной. .
.
 ,
,
 – объем одного моля газа.
– объем одного моля газа. и
и  Па объем одного моля любого газа равен
Па объем одного моля любого газа равен  .
. .
.
 .
.
 .
.
 определяет, сколько молей содержится в массе m. Объем одного моля
определяет, сколько молей содержится в массе m. Объем одного моля  .
.
 .
.
 .
.



