Примеры решения задач. 1. Из приведенного ряда металлов: Al, Ag, Ni, Hg указать те металлы, которые могут служить анодом в ГЭ в сочетании с медным катодом при стандартных
1. Из приведенного ряда металлов: Al, Ag, Ni, Hg указать те металлы, которые могут служить анодом в ГЭ в сочетании с медным катодом при стандартных условиях. Решение: По таблице 10.1 находим значения стандартных электродных потенциалов Al, Ag, Ni, Hg и Cu:
В гальваническом элементе напряжение
Ответ: Al; Ni.>
2. Указать, в каком случаи напряжение ГЭ, составленного из двух металлических электродов, погруженных в растворы своих солей при стандартных условиях будет наибольшим: а) Zn-Cu; б) Zn-Mg; в) Zn-Ag. Решение: Напряжение ГЭ равно разности потенциалов катода и анода: Катодом в ГЭ является тот электрод, значение потенциала которого больше φк0 > φА0. По таблице 6.1 находим значения стандартных электродных потенциалов, рассчитываем а) б) в) Следовательно, наибольшим будет стандартное напряжение равные 1,61В. Ответ: б) Zn-Mg.
3. Указать правильные значения электродного потенциала водородного электрода, рН раствора которого равно 7. а) – 0,23В; б) -0,34В; в) – 0,41В; г) -0,57В. Решение: Значение электродного потенциала водородного электрода определяем по формуле: Ответ: в) – 0,41В
4. Алюминиевый электрод погружен в 5∙10-4 М раствор сульфата алюминия. Вычислить значение электродного потенциала алюминия.
По таблице 6.1 определяем Записываем уравнение электродного процесса, протекающего на поверхности алюминиевого электрода в растворе своей соли: Al = Al3+ + 3ē n – число электронов, участвующих в электродном процессе. Для данной реакции n равно заряду иона алюминия Al3+(n=3). Рассчитываем концентрацию ионов алюминия в растворе Al2(SO4)3:
Разбавленный раствор Al2(SO4)3 – сильный электролит. Следовательно, α = 1. По уравнению диссоциации Al2(SO4)3: Al2(SO4)3 = 2Al3+ + 3SO Тогда Рассчитываем электродный потенциал алюминиевого электрода.
Ответ:
5) Потенциал цинкового электрода, погруженного в раствор своей соли, равен (-0,86В). Вычислить концентрацию ионов цинка в растворе.
Откуда: По таблице 6.1 определяем стандартный электродный потенциал цинка
Тогда:
Ответ: 5. Составить две схемы гальванических элементов (ГЭ), в одной из которых олово служило бы анодом, в другой – катодом. Для одной из них написать уравнения электродных процессов и суммарной токообразующей реакции. Вычислить значение стандартного напряжения ГЭ. Решение: В гальваническом элементе анодом является более активный металл с меньшим значением электродного потенциала, катодом – менее активный металл с большим значением электродного потенциала. По таблице 6.1 находим а) Олово - анод ГЭ. В качестве катода можно выбрать любой металл с
б) Олово - катод ГЭ. В качестве анода ГЭ можно выбрать любой металл с Например, магний В паре Mg-Sn – магний является анодом, олово – катодом. Составляем схему ГЭ: А(-) Mg │ Mg2+ ││ Sn2+ │ Sn(+) K или А(-) Mg │ MgSO4 ││ SnSO4 │ Sn(+) K
6. Составить схему коррозионного гальванического элемента, возникающего при контакте железа с цинком в: Решение: По таблице 6.1 находим значение стандартных электродных потенциалов железа и цинка: Так как
а) Коррозия в атмосферных условиях (H2O + O2). Составляем схему коррозионного ГЭ, уравнение реакции коррозионного процесса:
б) Коррозия в кислой среде (H2SO4)
в) Коррозия в кислой среде в присутствии кислорода (HCl+O2).
|

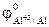 = -1,67 В;
= -1,67 В; 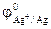 = +0,80 В;
= +0,80 В; 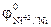 = -0,25 В;
= -0,25 В;  = +0,86 В;
= +0,86 В;  = +0,34 В.
= +0,34 В.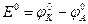 >0. Определим возможные знаки
>0. Определим возможные знаки 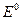 в предположении, что медный электрод – катод:
в предположении, что медный электрод – катод: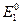 =
= 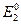 =
= 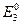 =
= 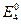 =
= 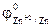 = -0,76 В
= -0,76 В 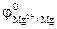 = -2,37 В
= -2,37 В  . Тогда, при рН=7,
. Тогда, при рН=7,  ; Следовательно, электродный потенциал водородного электрода при рН=7 равен – 0,41 В.
; Следовательно, электродный потенциал водородного электрода при рН=7 равен – 0,41 В. = 5∙10-4 М
= 5∙10-4 М
 -?
-?

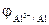 =
= 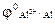 +
+ 
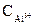 =
= 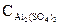 ∙α∙
∙α∙ 
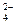 число ионов Al3+, образующихся при диссоциации одной молекулы Al2(SO4)3 равно 2. Следовательно,
число ионов Al3+, образующихся при диссоциации одной молекулы Al2(SO4)3 равно 2. Следовательно, 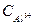 = 5∙10-4∙1∙2 =
= 5∙10-4∙1∙2 =  моль/л
моль/л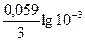 = -1,73 В
= -1,73 В
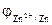 = -0,80B
= -0,80B
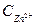 -?
-?
 +
+ 
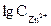 =
= 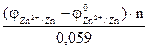
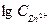 =
= 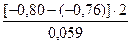 = - 1,36
= - 1,36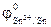 = -0,14В
= -0,14В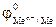 >
> 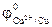 = + 0,34 В.
= + 0,34 В.
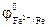 = - 0,44В,
= - 0,44В, 





