Примеры решения задач. 1. Указать, какие группы катионов металлов можно восстановить до
1. Указать, какие группы катионов металлов можно восстановить до металла методом электролиза из водных растворов: а)Rb+, Ba2+, Ni2+, Cu2+; б) Ag+, Bа2+, Zn2+, Al3+; в) Ni2+, Ag+, Hg2+, Pt2+; г) Mg2+, Ti2+, Cr3+, Sb3 +? Решение: Методом электролиза из водных растворов можно восстановить до металла катионы тех металлов, для которых Ni ( Ag ( Hg ( Pt (
Ответ: в) методом электролиза из водных растворов можно восстановить до металла катионы Ni2+, Ag+, Hg2+, Pt2+.
2. Указать, какие группы анионов можно окислить методом электролиза из водных растворов: а) Cl б) Cl в) SiO г) PO Решение: При электролизе водных растворов могут окисляться только анионы бескислородных кислот. Следовательно, из предложенных групп анионов методом электролиза из водных растворов можно окислить анионы Cl Ответ: б) Cl
3. Указать, восстановление каких групп катионов металлов при электролизе водных растворов сопровождается выделением водорода из водного раствора: а) K+, Mg2+, Mn2+, Bi3+; б) Al3+, Zn2+, Cr3+, Fe2+; в) Sr2+, Cu2+, Pt2+, Pd2+; г) Cd2+, Ni2+, Sn2+, Pb2+. Решение: Одновременно с ионами металлов восстанавливаются молекулы воды или ионы водорода с выделением водорода, если
Таким образом, при электролизе водных раствороввосстановление Cd2+, Ni2+, Sn2+, Pb2+ сопровождается выделением водорода из водного раствора: Ответ: г) Cd2+, Ni2+, Sn2+, Pb2+.
4.Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей (анод инертный): а) хлорида меди (II), б) гидроксида натрия. Какие продукты выделяются на катоде и аноде?
б) NaОН = Na+ + ОН -
Kатод(-): 2H2O+2ē = H2+2OH- Aнод (+) инертный: 4ОН На катоде выделяется Н2, на аноде выделяется О2.
5. Составить схемы электролиза и написать уравнения электродных процессов водного раствора соли сульфата никеля (II), если: а) анод инертный, б) анод никелевый. Какие продукты выделяются на катоде и аноде?
б) анод – никелевый: NiSO4 ↹ Ni2+ + K(-): Ni2+ + 2ē = Ni 2H2O+2ē=H2+2OH A(+): Ni - 2ē = Ni2+ На катоде выделяется Ni и H2, на аноде растворяется (окисляется) Ni. 6. При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить какое вещество и в каком количестве выделилось на катоде? Анод инертный.
На катоде выделилось 1120 см3 водорода.
б) AgNO3 ↹ Ag+ + Схема электролиза: K(-): Ag+ + ē = Ag A(+): 2H2O-4ē=О2+4H
На катоде выделяется Ag, на аноде выделяется О2. По закону эквивалентов: nЭК (Ag)(катод) = nЭК (О2)(анод) или:
На катоде выделилось 10,8 г серебра.
|

 превышают электродный потенциал выделения водорода из водного раствора (–1,4 В). В таблице 10.1 приведены значения
превышают электродный потенциал выделения водорода из водного раствора (–1,4 В). В таблице 10.1 приведены значения  =-0,25В),
=-0,25В), =+0,80В),
=+0,80В), =+0,86В),
=+0,86В), =+1,20В.
=+1,20В. , SO
, SO  , S
, S  , PO
, PO  ;
; , I
, I  , CO
, CO  , ClO
, ClO  ;
; = -1,4…0 В. Из указанных рядов металлов условие выполняется для ряда г) Cd2+, Ni2+, Sn2+, Pb2+:
= -1,4…0 В. Из указанных рядов металлов условие выполняется для ряда г) Cd2+, Ni2+, Sn2+, Pb2+: =-0,40В,
=-0,40В, =-0,25В,
=-0,25В, =-0,14В,
=-0,14В,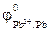 =-0,13В
=-0,13В
 Схему электролиза составляем в соответствии с таблицами 1 и 2:
K(-): Ni2+ + 2ē = Ni
2H2O+2ē=H2+2OH-
A(+): 2H2O-4ē=О2+4H+
На катоде выделяется Ni и H2, на аноде выделяется О2.
Схему электролиза составляем в соответствии с таблицами 1 и 2:
K(-): Ni2+ + 2ē = Ni
2H2O+2ē=H2+2OH-
A(+): 2H2O-4ē=О2+4H+
На катоде выделяется Ni и H2, на аноде выделяется О2.
 анод = 560 см3
Анод инертный
Схема электролиза-?
анод = 560 см3
Анод инертный
Схема электролиза-?
 -?
-?
 -?
-?

 Схема электролиза:
K(-): 2H2O+2ē=H2+2OH-
A(+): 2H2O-4ē=О2+4H+
На катоде выделяется Н2, на аноде выделяется О2
По закону эквивалентов: nЭК (В1)(анод) = nЭК (В2)(катод)
В соответствии со схемой электролиза: nЭК (О2)(анод) = nЭК (Н2)(катод) или:
Схема электролиза:
K(-): 2H2O+2ē=H2+2OH-
A(+): 2H2O-4ē=О2+4H+
На катоде выделяется Н2, на аноде выделяется О2
По закону эквивалентов: nЭК (В1)(анод) = nЭК (В2)(катод)
В соответствии со схемой электролиза: nЭК (О2)(анод) = nЭК (Н2)(катод) или:
 , откуда
, откуда  =
=  =
=  = 1120 см3,
= 1120 см3, = 11200 см3/моль,
= 11200 см3/моль,  = 5600 см3/моль.
= 5600 см3/моль.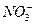
 , откуда
, откуда 
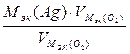 =
=  = 10,8 г, где
= 10,8 г, где  .
.


