Примеры решения задач. Пример 2.1.На восстановление 7,09 г оксида металла со степенью окисления +2 требуется 2,24 л водорода (н
Пример 2.1. На восстановление 7,09 г оксида металла со степенью окисления +2 требуется 2,24 л водорода (н. у.). Вычислите молярные массы эквивалентов оксида и металла. Чему равна молярная масса металла? Решение. Задача решается по закону эквивалентов. Так как одно из реагирующих веществ находится в газообразном состоянии, то удобно воспользоваться формулой Напомним, что объем 1 моль эквивалентов водорода равен 11,2 л (н. у.), тогда Мэк(ок) = Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Оксид – это соединение металла с кислородом, поэтому молярная масса эквивалентов оксида представляет собой сумму Мэк (оксида) = Мэк (металла) + Мэк (кислорода). Отсюда Мэк (металла) = Мэк (оксида) – Мэк (кислорода) = 35,45 – 8 = 27,45 г/моль. Молярная масса металла определяется из соотношения Мэк(металла) = Пример 2.2. При взаимодействии кислорода с азотом получено 4 моль эквивалентов оксида азота (IV). Рассчитайте объемы газов, вступивших в реакцию при н. у. Решение. По закону эквивалентов число молей эквивалентов веществ, вступающих в реакцию и образующихся в результате реакции равны между собой, т.е. υ(О2) = υ(N2) = υ(NO2). Так как получено 4 моль эквивалентов оксида азота (IV), то, следовательно, в реакцию вступило 4 моль эквивалентов О2 и 4 моль эквивалентов N2. Азот изменяет степень окисления от 0 (в N2) до +4 (в NО2), и так как в его молекуле 2 атома, то вместе они отдают 8 электронов, поэтому Мэк(N2)= 28 г/моль N2 – 22,4 л 3,5 г/моль N2 – х х = Так как в реакцию вступило 4 моль эквивалентов N2, то их объем составляет V(N2) = 2,8·4 = 11,2 л. Зная, что моль эквивалентов кислорода при н. у. занимает объем 5,6 л, рассчитываем объем 4 моль эквивалентов О2, вступивших в реакцию: V(O2) = 5,6·4 = 22,4 л. Итак, в реакцию вступило 11,2 л азота и 22,4 л кислорода. Пример 2.3. Определите молярную массу эквивалентов металла, если из 48,15 г его оксида получено 88,65 г его нитрата. Решение. Учитывая, что Мэк(оксида) = Мэк(металла) + Мэк(кислорода), а Мэк(соли) = Мэк(металла) + Мэк(кислотного остатка), подставляем соответствующие данные в закон эквивалентов:
Пример 2.4. Вычислите степень окисления хрома в оксиде, содержащем 68,42 % (масс.) этого металла. Решение. Приняв массу оксида за 100%, находим массовую долю кислорода в оксиде: 100 – 68,42 = 31,58%, т.е. на 68,42 частей массы хрома приходится 31,58 частей массы кислорода, или на 68,42 г хрома приходится 31,58 г кислорода. Зная, что молярная масса эквивалентов кислорода равна 8 г/моль, определим молярную массу эквивалентов хрома в оксиде по закону эквивалентов:
Степень окисления хрома находим из соотношения Мэк(Cr)=
Задачи 21. При взаимодействии 6,75 г металла с серой образовалось 18,75 г сульфида. Рассчитайте молярные массы эквивалентов металла и его сульфида. Молярная масса эквивалентов серы равна 16 г/моль. (Ответ: 9 г/моль; 25 г/моль). 22. Вычислите степень окисления золота в соединении состава: 64,9% золота и 35,1% хлора. Молярная масса эквивалентов хлора 35,45 г/моль. (Ответ: 3). 23. Вычислите молярные массы эквивалентов и эквиваленты Р2О5 в реакциях, идущих по уравнениям: Р2О5 + 3MgO = Mg3(PO4)2; (1) P2O5 + MgO = Mg(PO3)2. (2) (Ответ: 23,7 г/моль; 71 г/моль; 1/6 Р2О5; 1/2 Р2О5). 24. Сколько молей эквивалентов металла вступило в реакцию с кислотой, если при этом выделилось 5,6 л водорода при нормальных условиях? (Ответ: 0,5 моль). 25. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите молярную массу эквивалентов кислоты. (Ответ: 41 г/моль). 26. Определите молярную массу эквивалентов металла и назовите металл, если 8,34 г его окисляются 0,68 л кислорода (н. у.). Металл окисляется до степени окисления +2. (Ответ: 68,7 г/моль). 27. Вычислите степень окисления свинца в оксиде, в котором на 1 г свинца приходится 0,1544 г кислорода. (Ответ: 4). 28. Вычислите эквивалент и молярную массу эквивалентов Al(OH)3 в каждой из следующих реакций, выраженных уравнениями: Al(OH)3 + 3HCl = AlCl3 + 3H2O; (1) Al(OH)3 + 2HCl = AlOHCl2 + 2H2O; (2) Al(OH)3 + HCl = Al(OH)2Cl + H2O. (3) 29. Для получения гидроксида железа (III) смешали растворы, содержащие 0,2 моль эквивалентов щелочи и 0,3 моль эквивалентов хлорида железа (III). Сколько граммов гидроксида железа (III) получилось в результате реакции? (Ответ: 7,13 г). 30. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалентов этого металла. (Ответ: 9 г/моль). 31. При взаимодействии 22 г металла с кислотой выделилось при н. у. 8,4 л водорода. Рассчитайте молярную массу эквивалентов металла. Сколько литров кислорода потребуется для окисления этого же количества металла? (Ответ: 29,33 г/моль; 4,2 л.). 32. Вычислите степень окисления мышьяка в соединении его с серой, в котором на 1 г мышьяка приходится 1,07 г серы. Молярная масса эквивалентов серы 16 г/моль. (Ответ: 5). 33. Вычислите эквивалент и молярную массу эквивалентов Н3РО4 в каждой из следующих реакций, выраженных уравнениями: Н3РО4 + КОН = КН2РО4 + Н2О; (1) Н3РО4 + 2КОН = К2НРО4 + 2Н2О; (2) Н3РО4 + 3КОН = К3РО4 + 3Н2О. (3) 34. При взаимодействии водорода и азота получено 6 моль эквивалентов аммиака. Какие объемы водорода и азота вступили при этом в реакцию при нормальных условиях? (Ответ: 67,2 л; 22,4 л.) 35. При пропускании сероводорода через раствор, содержащий 2,98 г хлорида металла, образуется 2,2 г его сульфида. Вычислите молярную массу эквивалентов металла. (Ответ: 39 г/моль). 36. Молярная масса эквивалентов металла равна 56,2 г/моль. Вычислите массовую долю металла в его оксиде. (Ответ: 87,54%). 37. Определите эквивалент и молярную массу эквивалентов азота, кислорода, углерода в соединениях NH3, H2O, CH4. 38. Рассчитайте молярную массу эквивалентов металла, если при взаимодействии 7,2 г металла с хлором было получено 28,2 г соли. Молярная масса эквивалентов хлора равна 35,45 г/моль. (Ответ: 12,15 г/моль). 39. Рассчитайте молярную массу эквивалентов воды при реакции ее: а) с металлическим натрием; б) с оксидом натрия. (Ответ: 18 г/моль; 9 г/моль). Г металла при реакции с кислотой вытеснили при н. у. 123,3 мл водорода. 1,555 г этого же металла вступают во взаимодействие с 1,415 г некоторого неметалла. Рассчитайте молярную массу эквивалентов неметалла. (Ответ: 35,5 г/моль).
|

 ,
,  .
. г/моль.
г/моль. , отсюда МА = Мэк(металла)×½с.о.½ = 27,45×2 = 54,9 г/моль. Таким образом, Мэк(оксида) = 35,45 г/моль; Мэк (металла) = 27,45 г/моль; МА(металла) = 54,9 г/моль.
, отсюда МА = Мэк(металла)×½с.о.½ = 27,45×2 = 54,9 г/моль. Таким образом, Мэк(оксида) = 35,45 г/моль; Мэк (металла) = 27,45 г/моль; МА(металла) = 54,9 г/моль. =
=  =3,5 г/моль. Находим объем, занимаемый молем эквивалентов азота (IV):
=3,5 г/моль. Находим объем, занимаемый молем эквивалентов азота (IV): л.
л. ;
; 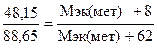 ; Мэк(мет) = 56,2 г/моль.
; Мэк(мет) = 56,2 г/моль. ; Мэк(Cr)=
; Мэк(Cr)=  г/моль.
г/моль. , отсюда |c. o.|=
, отсюда |c. o.|=  .
.


