Эквивалент. Закон эквивалентов. Эквивалент(Э)– это реальная или условная частица вещества, которая может замещать, присоединять или выделять один ион водорода в кислотно-основных или
Эквивалент (Э) – это реальная или условная частица вещества, которая может замещать, присоединять или выделять один ион водорода в кислотно-основных или ионообменных реакциях или один электрон в окислительно-восстановительных реакциях. Под «реальной частицей» понимают реально существующие соединения (КОН, H2SO4, Н2О), под «условной» – доли этих реальных частиц (½H2SO4, 1/5KMnO4). Эквивалент так же, как атом, молекула, ион – безразмерная величина, и его состав выражают с помощью химических формул и символов. Количество вещества эквивалентов измеряется в молях. Масса 1 моль эквивалентов называется молярной массой эквивалентов (Мэк) и выражается в г/моль. Эквивалент (молярная масса эквивалентов) для одного и того же вещества может иметь различные значения в зависимости от того, в какую реакцию это вещество вступает. Эквивалент и Мэк рассчитываются неодинаково для кислотно-основных и окислительно-восстановительных реакций. Молярная масса эквивалентов вещества, участвующего в окислительно-восстановительной реакции, рассчитывается как: Мэк где М – молярная масса вещества; nе– число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя. Например, в окислительно-восстановительной реакции горения сероводорода 2H2S + 3O2 = 2H2O + 2SO2 степень окисления серы изменяется от –2 (в H2S) до +4 (в SO2). Следовательно, молекула H2S теряет 6 электронов, т. е. одному электрону эквивалентна условная частица 1/6 молекулы H2S. Э(H2S) = 1/6H2S, а Мэк(H2S) = У кислорода степень окисления меняется от 0 (в О2) до –2 (в SO2), и так как в его молекуле содержится 2 атома, то число принятых электронов будет равно 4. Таким образом, одному электрону эквивалентна условная частица ¼ молекулы О2: Э(О2) = ¼О2, а Мэк (О2) = Молярная масса эквивалентов кислоты или основания, участвующихв кислотно-основной реакции, рассчитывается по формуле Мэк(кислоты, основания)= где М – молярная масса кислоты или основания; n – для кислот – число атомов водорода, замещенных в данной реакции на металл; для оснований – число гидроксильных групп, замещенных в данной реакции на кислотный остаток. Например, в кислотно-основной реакции H2S + 2NaOH = Na2S + 2H2O (1) оба иона водорода молекулы H2S замещаются на металл и, таким образом, одному иону водорода эквивалентна условная частица ½ H2S. В этом случае Э (H2S) = ½ H2S, а Мэк (H2S) = В реакции H2S + NaOH = NaHS + H2O (2) в молекуле H2S на металл замещается только один ион водорода и, следовательно, одному иону Э(H2S) = H2S, а Мэк(H2S) = Э(NaOH) в реакциях (1) и (2) равен NaOH, так как в обоих случаях на кислотный остаток замещается одна гидроксильная группа. Мэк(NaOH) = 40 г/моль. Молярная масса эквивалентов соли в реакциях обмена рассчитывается по формуле Мэк(соли)= где М – молярная масса соли; n – число ионов металла, участвующих в реакции от каждой молекулы; |c. o.| – абсолютное значение степени окисления иона металла (о степени окисления см. с. 82). Например, от каждой молекулы Al2(SO4)3 в реакции Al2(SO4)3 + 6NaOH = 2Al(OH)3↓ + 3Na2SO4 участвуют два иона алюминия, степень окисления которого+3. Отсюда Мэк[Al2(SO4)3]= Молярная масса эквивалентов оксида Мэк(оксида)= где М – молярная масса оксида; n – число катионов соответствующего оксиду основания или число анионов соответствующей оксиду кислоты; |c.o.| – абсолютное значение степени окисления катиона или аниона. В реакции P2O5 + 3CaO = Ca3(PO4)2 эквивалент P2O5, образующего два трехзарядных аниона (РО4)3-, равен 1/6 P2O5, а Мэк(P2O5) = Чтобы определить молярную массу эквивалентов элемента в соединении, можно воспользоваться формулой Мэк (эл-та) = где МА – молярная масса элемента; |c.o.| – абсолютное значение степени окисления элемента. Например, молярные массы эквивалентов фосфора в соединениях РН3, Р2О3 и Р2О5, соответственно, равны: 31 / 3 = 10,3 г/моль; 31 / 3 = 10,3 г/моль; 31 / 5 = 6,2 г/моль, а эквивалент фосфора в соединениях РН3 и Р2О3 равен 1/3 Р, в соединении Р2О5 – 1/5 Р. Нужно также иметь в виду, что молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Так, Мэк(РН3) = Мэк(Р) + Мэк(Н) = 10,3 + 1 = 11 г/моль; Мэк(Р2О3) = Мэк(Р) + Мэк(О) = 10,3 + 8 = 18,3 г/моль; Мэк(Р2О5) = Мэк(Р) + Мэк(О) = 6,2 + 8 = 14,2 г/моль. Закон эквивалентов: массы реагирующих друг с другом веществ прямо пропорциональны молярным массам их эквивалентов:
Поделив массу каждого вещества на молярную массу его эквивалентов, получим число молей эквивалентов (υ): Для реакции A + B = C + D должно выполняться соотношение υA=υB=υC=υD, т.е. число молей эквивалентов веществ, участвующих в реакции равны между собой. Если одно из реагирующих веществ находится в газообразном состоянии, закон эквивалентов удобно представить в виде
где Vэк – объем одного моля эквивалентов газа. Для вычисления объема моля эквивалентов газа необходимо знать число молей эквивалентов (υ) в одном моле газа: υ =
|

 ,
, .
. .
.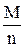 ,
, .
. эквивалентна реальная частица – молекула H2S. В этом случае
эквивалентна реальная частица – молекула H2S. В этом случае =
=  34 г/моль.
34 г/моль. ,
, = 57 г/моль, Э[Al2(SO4)3] равен 1/6 Al2(SO4)3.
= 57 г/моль, Э[Al2(SO4)3] равен 1/6 Al2(SO4)3. ,
, г/моль. Эквивалент СаО, дающего один двухзарядный катион (
г/моль. Эквивалент СаО, дающего один двухзарядный катион (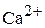 ), равен ½ СаО, а Мэк (СаО) =
), равен ½ СаО, а Мэк (СаО) =  =
=  28 г/моль.
28 г/моль. ,
, .
. , или υ1= υ2.
, или υ1= υ2.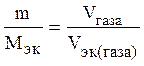 ,
, . Так, М(Н2) = 2 г/моль; Мэк(Н2) = 1 г/моль. Следовательно, в одном моле молекул водорода Н2 содержится υ = 2/1 = 2 моль эквивалентов водорода. Как известно, моль любого газа при нормальных условиях (н. у.) (Т=273 К, р=101,325 кПа) занимает объем 22,4 л. Значит, моль водорода займет объем 22,4 л, а так как в одном моле водорода содержится 2 моль эквивалентов водорода, то объем одного моля эквивалентов водорода равен Vэк(Н2) = 22,4 / 2 = 11,2 л. Аналогично М(О2) = 32 г/моль, Мэк (О2) = 8 г/моль. В одном моле молекул кислорода О2 содержится υ = 32 / 8 = 4 моль эквивалентов кислорода. Один моль эквивалентов кислорода занимает объем Vэк(О2) = 22,4 / 4 = 5,6 л.
. Так, М(Н2) = 2 г/моль; Мэк(Н2) = 1 г/моль. Следовательно, в одном моле молекул водорода Н2 содержится υ = 2/1 = 2 моль эквивалентов водорода. Как известно, моль любого газа при нормальных условиях (н. у.) (Т=273 К, р=101,325 кПа) занимает объем 22,4 л. Значит, моль водорода займет объем 22,4 л, а так как в одном моле водорода содержится 2 моль эквивалентов водорода, то объем одного моля эквивалентов водорода равен Vэк(Н2) = 22,4 / 2 = 11,2 л. Аналогично М(О2) = 32 г/моль, Мэк (О2) = 8 г/моль. В одном моле молекул кислорода О2 содержится υ = 32 / 8 = 4 моль эквивалентов кислорода. Один моль эквивалентов кислорода занимает объем Vэк(О2) = 22,4 / 4 = 5,6 л.


