Строение атома. Атом – это наименьшая частица химического элемента, сохраняющая все его химические свойства
Атом – это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов. Заряд ядра атома численно равен порядковому номеру элемента в периодической системе. Так как атом в целом электронейтрален, то и число электронов, движущихся вокруг ядра атома, равно порядковому номеру. Например, порядковый номер натрия 11. Значит, заряд ядра атома натрия +11. Вокруг ядра размещается 11 электронов с общим отрицательным зарядом –11. Все электроны атома образуют его электронную оболочку, строение которой определяет многие химические свойства элемента. Электроны характеризуются двойственной природой: они имеют свойства и частицы, и волны. Для движущегося электрона невозможно указать его точное местоположение, можно лишь определить вероятность нахождения электрона в различных частях внутриатомного пространства. Область пространства, в которой наиболее вероятно нахождение электрона, называется атомной орбиталью (АО). Состояние электрона в атоме характеризуется четырьмя квантовыми числами. Главное квантовое число n определяет энергию электрона в атоме и размер АО, т.е. удаленность электрона от ядра. Главное квантовое число n принимает значения целых чисел 1, 2, 3, 4… Совокупность электронов с одинаковым значением n называется энергетическим уровнем. Наименьшую энергию имеют электроны первого от ядра энергетического уровня (n =1); с увеличением n энергия электрона и его удаленность от ядра возрастают. Состояние атома, когда его электроны находятся на таких энергетических уровнях, что их суммарная энергия является минимальной, называется основным, или невозбужденным. Состояния с более высокими значениями энергии называются возбужденными. Энергетические уровни обозначают буквами: Числовое значение n 1 2 3 4 5 6 7 Буквенное обозначение K L M N O P Q. Число энергетических уровней в атоме, находящемся в основном состоянии, равно номеру периода, в котором находится элемент. На одном и том же энергетическом уровне могут находиться атомные орбитали различной формы, отличающиеся друг от друга по энергии. Поэтому энергетические уровни разделяются на подуровни. Энергию электрона на подуровне и форму атомной орбитали характеризует орбитальное квантовое число l. Значение l зависит от главного квантового числа: l принимает значения от 0 до (n –1), т. е. 0, 1, 2, 3… (n –1). В пределах данного энергетического уровня совокупность электронов, характеризующихся одинаковым значением l, называется энергетическим подуровнем. Подуровни обозначают буквами: Орбитальное квантовое число l 0 1 2 3 Обозначение энергетического подуровня s p d f. Таким образом, при l =0, 1, 2, 3 электроны находятся соответственно на s-, p-, d-, f- подуровнях. Электроны различных подуровней называют s-, p-, d-, f- электронами. В этом случае говорят также о состояниях s-, p-, d-, f- электронов, или s-, p-, d-, f- атомных орбиталях. Число энергетических подуровней в уровне не должно быть больше главного квантового число n. Так, первый уровень (n =1) имеет один подуровень (s), второй уровень (n =2) – два подуровня (s и p), третий (n =3) – три (s, p, d), четвертый (n =4) – четыре (s, p, d, f). В оболочках атомов ныне известных элементов электроны застраивают на каждом уровне не более четырех подуровней. Уровни O (n =5), P (n =6), Q (n =7) содержат по четыре подуровня. При данном значении главного квантового числа n наименьшую энергию имеют электроны s -подуровня, затем p-, d-, f- подуровней. Каждый подуровень составлен из орбиталей, число которых определяется магнитными квантовым числом ml. Магнитное квантовое число ml определяет возможные ориентации орбитали в пространстве, связано с орбитальным квантовым числом и может принимать целочисленные значения от –l до +l, включая ноль. Определенному значению l соответствует (2l+1) возможных значений магнитного квантового числа. Число значений ml указывает на число атомных орбиталей в подуровне и число возможных направлений, по которым они могут ориентироваться в пространстве. Для s -подуровня l =0 и потому ml имеет единственное значение: ml =0. Таким образом, на s -подуровне имеется единственная s -орбиталь, которая расположена симметрично ядру атома. Для p -подуровня l =1 и ml приобретает три значения: –1, 0, 1, т. е. р- подуровень имеет три р -орбитали и они ориентированы по трем осям координат. d -подуровень с l =2 имеет пять значений ml: –2, –1, 0, 1, 2 и, следовательно, пять d -орбиталей, которые ориентированы по пяти разным направлениям. f -подуровень с l =3 имеет семь значений ml: –3, –2, –1, 0, 1, 2, 3, т. е. семь f- орбиталей. Число ориентаций f- орбиталей равно семи. Условно АО обозначают в виде квадрата (квантовой ячейки). Соответственно для s -подуровня имеется - одна АО, для p -подуровня – три АО, для d -подуровня - пять АО, для f- подуровня - семь АО. Таким образом, электроны в атоме располагаются по энергетическим уровням, удаленность которых от ядра характеризуется значением главного квантового числа n; уровни состоят из подуровней, число которых для каждого уровня не превышает значение n; в свою очередь, подуровень состоит из орбиталей, количество которых задается числом значений магнитного квантового числа ml. Квантовые числа n, l, ml характеризуют орбиталь. Кроме движения вокруг ядра, электрон вращается вокруг собственной оси. Это движение получило название «спин». Спиновое квантовое число ms характеризует два возможных направления вращения электрона вокруг собственной оси (по часовой стрелке или против). Спиновое квантовое число ms принимает два значения: +½ и –½. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками ↓↑. Четыре квантовых числа n, l, ml, ms полностью характеризуют состояние электрона в атоме. Согласно принципу Паули в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Принцип Паули определяет максимальное число электронов на одной орбитали, уровне и подуровне. Так как АО характеризуется тремя квантовыми числами n, l, ml, электроны данной орбитали могут различаться только спиновым квантовым числом ms. Но ms может иметь только два значения +½ и –½. Следовательно, на одной орбитали может находиться не более двух электронов с противоположно направленными спинами Последовательность заполнения электронами орбиталей осуществляется в соответствии с принципом минимальной энергии, согласно которому электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. Очередность орбиталей по энергии определяется правилом Клечковского: увеличение энергии, и соответственно, заполнение орбиталей происходит в порядке возрастания суммы (n+l), а при равной сумме (n+l) – в порядке возрастания n. Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией. При записи электронной конфигурации номер уровня (главное квантовое число) обозначают цифрами 1, 2, 3, 4…, подуровень (орбитальное квантовое число) – буквами s, p, d, f. Число электронов в подуровне обозначается цифрой, которая записывается вверху у символа подуровня. Например, электронная конфигурация атома серы имеет вид 16S 1 s 22 s 22 p 63 s 23 p 4, а ванадия 23V 1 s 22 s 22 p 6 3 s 23 p 63 d 34 s 2. Таблица 2.1 Максимальное число электронов на квантовых уровнях и подуровнях
Химические свойства атомов определяются, в основном, строением наружных энергетических уровней, которые называются валентными. Полностью завершенные энергетические уровни в химическом взаимодействии не участвуют. Поэтому часто для краткости записи электронной конфигурации атома их обозначают символом предшествующего благородного газа. Так, для серы: [Ne]3 s 23 p 4; для ванадия: [Ar]3 d 34 s 2. Одновременно сокращенная запись наглядно выделяет валентные электроны, определяющие химические свойства атомов элемента. В зависимости от того, какой подуровень в атоме заполняется в последнюю очередь, все химические элементы делятся на 4 электронных семейства: s-, p-, d-, f- элементы. Элементы, у атомов которых в последнюю очередь заполняется s- подуровень внешнего уровня, называются s- элементами. У s- элементов валентными являются s -электроны внешнего энергетического уровня. У р- элементов последним заполняется р- подуровень внешнего уровня. У них валентные электроны расположены на p- и s- подуровнях внешнего уровня. У d- элементов в последнюю очередь заполняется d- подуровень предвнешнего уровня и валентными являются s- электроны внешнего и d- электроны предвнешнего энергетического уровней. У f- элементов последним заполняется f- подуровень третьего снаружи энергетического уровня. Электронная конфигурация атома может быть изображена также в виде схем размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. В каждой квантовой ячейке может быть не более двух электронов с противоположно направленными спинами 16S Суммарный спин р- электронов третьего энергетического уровня атома серы S ms = ½ – ½ + ½ + ½ = 1; d -электронов атома ванадия – S ms = ½ + ½ + ½ = 3/2. Часто графически изображают не всю электронную формулу, а лишь те подуровни, на которых находятся валентные электроны, например, 16S…3 s 2 3 p 4 При графическом изображении электронной конфигурации атома в возбужденном состоянии наряду с заполненными изображают вакантные валентные орбитали. Например, в атоме фосфора на третьем энергетическом уровне имеются одна s -АО, три р -АО и пять d -АО. Электронная конфигурация атома фосфора в основном состоянии имеет вид 15Р… 3 s 2 3 p 3 Валентность фосфора, определяемая числом неспаренных электронов, равна 3. При переходе атома в возбужденное состояние происходит распаривание электронов состояния 3 s и один из электронов с s -подуровня может перейти на d -подуровень: Р*… 3 s2 3 p 3 3 d 1 При этом валентность фосфора меняется с трех (РСl3) в основном состоянии до пяти (РCl5) в возбужденном состоянии.
|

 . Максимальное число электронов на энергетическом уровне определяется как 2 n 2, а на подуровне – как 2(2 l +1). Максимальное число электронов, размещающихся на различных уровнях и подуровнях, приведены в табл. 2.1.
. Максимальное число электронов на энергетическом уровне определяется как 2 n 2, а на подуровне – как 2(2 l +1). Максимальное число электронов, размещающихся на различных уровнях и подуровнях, приведены в табл. 2.1. 23V
23V 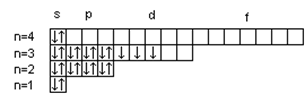
 ; 23V…3 d 34 s 2
; 23V…3 d 34 s 2  .
.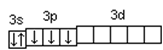 .
.



