Прогноз
Профилактику восходящего холангита осуществляют созданием антирефлюксного механизма в изолированной тощей кишке. Выполнение радикальной операции до развития цирроза печени даёт благоприятные результаты.
5.14.3. Острый холецистит Острый воспалительный процесс в жёлчном пузыре у детей развивается редко, чаще его регистрируют в старшей возрастной группе.
Классификация В основе классификации острого холецистита лежит принцип оценки степени деструкции стенки жёлчного пузыря. Выделяют не-Деструктивную (катаральную) и деструктивную (флегмонозную, гангренозную и перфоративную) формы острого первичного воспаления жёлчного пузыря. Этиология и патогенез Инфекция в жёлчный пузырь может проникать энтерогенным путём из двенадцатиперстной кишки, гематогенным, реже лимфоген-ным путями. Возникновению инфекции способствует и застой жёлчи в жёлчном пузыре, у 65% больных обусловленный аномалиями развития. Тем не менее холецистэктомию в связи с деструктивными изменениями в жёлчном пузыре детям выполняют исключительно редко. По-видимому, попадание микробов в жёлчный пузырь ещё не означает развития воспалительного процесса. Современные функциональные исследования показывают, что в патологии жёлчевыделительной системы у детей более чем в 70% случаев выявляют дискинезию жёлчных путей. В связи с этим в детском возрасте чаще всего из-за нарушения оттока жёлчи происходит переполнение и растяжение жёлчного пузыря.
Клиническая картина и диагностика Клинические проявления острого холецистита у детей, как и при любом воспалительном процессе в брюшной полости, сопровождаются умеренно выраженной болью, одно- или двукратной рвотой, повышением температуры тела. При обследовании живота выявляют локальную болезненность и защитное мышечное напряжение в точке жёлчного пузыря — положительный симптом Ортнера. Острый холецистит практически невозможно отличить от острого аппендицита при высоком варианте ретроцекального (под-печёночного) расположения червеобразного отростка. Если при динамическом наблюдении удаётся отметить ухудшение состояния ребёнка (нарастают явления интоксикации, держится высокая температура тела), а местно в области правого подреберья более чётко определяется защитное мышечное напряжение, то хирурги обычно склоняются в сторону оперативного вмешательства. Однако только лапароскопия позволяет точно установить правильный диагноз.
Лечение Тактика при остром холецистите такая же, как при остром аппендиците. Прогноз Прогноз зависит от ранней диагностики и своевременно начатого лечения.
5.14.4. Хронический калькулёзный холецистит В детском возрасте калькулёзный холецистит — достаточно редкое заболевание. В отечественной и зарубежной литературе существуют лишь немногочисленные работы, представляющие единичные наблюдения. В последние годы педиатры и детские хирурги всё чаще стали выявлять эту болезнь у детей. Этому способствуют не только значительное улучшение диагностики, но и другие факторы, в частности изменение качественного состава питания, ухудшение экологической обстановки и т.п. Заболевание чаще возникает у детей старшего возраста. До 7 лет мальчики болеют в 2 раза чаще девочек, в возрасте от 8 до 10 лет соотношение между ними бывает равным, а в 12—14 лет девочки болеют в 3—4 раза чаще мальчиков. Довольно часто детей с желчнокаменной болезнью наблюдают педиатры по поводу заболеваний желудка и двенадцатиперстной кишки, почек, ожирения, дискинезии ЖКТ. Это обусловлено не только особенностями течения холелитиаза у детей в разных возрастных группах, но и недостаточной информированностью об этом заболевании как медицинских работников, так и родителей.
Классификация Различают несколько форм течения хронического калькулёзного холецистита: латентную, острую (проявляется печёночной коликой) и подострую (наблюдают при возникновении воспалительного процесса в стенке жёлчного пузыря).
Этиология и патогенез Среди основных факторов риска развития заболевания у детей отвечают длительное парентеральное питание, застой в жёлчном пузы-Ре, обширные резекции подвздошной кишки, гемолитическую болезнь и Др. Образованию камней способствуют пороки развития жёлчных пУтей, особенно пузырного протока и шейки жёлчного пузыря. В механизме образования камней в детском возрасте ведущую роль играют три основных фактора: генетическая предрасположенность, аномалии развития жёлчных путей и общие обменные нарушения. Каждый из них в отдельности следует считать лишь фактором, предрасполагающим к образованию конкрементов. Сочетание хотя бы двух из них может привести к развитию болезни.
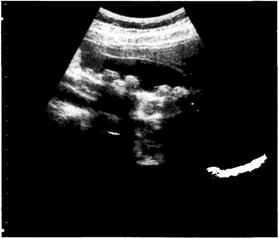
Клиническая картина В отличие от взрослых больных, клинические проявления желчнокаменной болезни в детском возрасте не имеют чёткого характерного симптомокомплекса. Течение заболевания у детей во многом зависит от возраста, сопутствующих заболеваний, наличия различных аномалий жёлчных путей, характера, размера и расположения конкрементов. Основной клинический симптом — рецидивирующая боль в животе. У детей раннего возраста боли в основном локализуются в области пупка или по всему животу. Дети старшего возраста, особенно в препубертатном и пубертатном периодах, чаще жалуются на боли в области правого подреберья, реже — в надчревной области. Боль в большинстве случаев сильная, иногда становится опоясывающей, иррадиирует в спину, правое плечо, лопатку. Ребёнок становится беспокойным, принимает вынужденное положение. Болевой синдром, как правило, сопровождается тошнотой или рвотой. Повышение температуры тела может указывать на развитие холе-цистохолангита. Желтушность возникает при закупорке конкрементом общего жёлчного протока, что у детей происходит крайне редко. При пальпации живота у всех больных определяют выраженную болезненность в правом подреберье. В большинстве случаев выявляют желчнопузырные симптомы (Ортнера, Кера, Мерфи). Клиническая картина желчнокаменной болезни зависит также от характера и размера конкрементов. У детей преимущественно возникают билирубиновые камни (до 75%), значительно реже — холестериновые и смешанные. Чем крупнее конкремент, тем менее выражены клинические проявления. Напротив, мелкие конкременты (а это в основном жёсткие билирубиновые камни), имеющие чаще коралловидную форму, вызывают острые приступообразные боли. Выраженный характер болей обусловлен тем, что мелкие камни довольно легко перемещаются и могут попасть в желчевыводящие протоки. Обращает на себя внимание большая частота так называемых бессимптомных форм желчнокаменной болезни. Глава 5 ❖ Пороки развития и заболевания брюшной стенки ^ 365 Диагностика В диагностике заболевания решающее значение имеет УЗИ. Рентгенологические исследования в настоящее время практически не применяют, так как 40—50% камней желчевыделительной системы рентгенонегативны. По показаниям проводят эндоскопическую ретроградную холецистопанкреатографию (ЭРХПГ).
УЗИ В ходе УЗИ оценивают следующие характеристики. • Размеры жёлчного пузыря. Отчётливое увеличение их по сравнению с возрастной нормой отмечают у 25% больных, гипоплазию пузыря со значительным уменьшением размеров — у 15%. • Форма жёлчного пузыря — наличие перегибов и перетяжек в области его тела и шейки. У 65% детей выявляют выраженную деформацию органа (перегиб или перетяжку) в области шейки. • Толщина и эхографическая плотность стенки жёлчного пузыря в разных участках. У всех детей отмечают уплотнение стенки жёлчного пузыря до 2—6 мм (в среднем до 2,8 мм). У некоторых детей, поступающих с острой клинической картиной патологического процесса в брюшной полости (как правило, с подозрением на острый аппендицит), при УЗИ выявляют чёткую слоистость стенки пузыря, что подтверждает диагноз острого холецистита. • Характер содержимого жёлчного пузыря. У 95% детей в нём обнаруживают жидкое эхонегативное содержимое — жёлчь; у 5% детей с большим количеством разнокалиберных конкрементов жёлчь в пузыре отсутствует (так называемый отключённый жёлчный пузырь). • Наличие, ориентировочное количество, локализация, смещае-мость, эхо-плотность и размеры конкрементов. Конкременты разной эхо-плотности выявляют у всех больных, подвижные конкременты — у 80%, неподвижные — у 20%. Все неподвижные камни обычно располагаются в шейке жёлчного пузыря. Единичные конкременты обнаруживают у 65% больных, множественные — у 80% (рис. 5-33, 5-34). • Состояние общего жёлчного протока. В крупных протоках конкременты у детей выявляют исключительно редко. Незначительное Расширение общего жёлчного протока (до 5-6 мм) обнаруживают не более чем у 5% больных, что служит абсолютным показанием к
Рис. 5-34. УЗИ жёлчного пузыря (множественные камни).
проведению ЭРХПГ. У остальных пациентов диаметр общего жёлчного протока на всём протяжении соответствует возрастной норме. • Наличие изменений вокруг жёлчного пузыря, которые могут свидетельствовать об осложнённой форме холецистита. Такие состояния способны значительно усложнить выполнение лапароскопической операции, а в некоторых случаях стать причиной осложнений. Исследование жёлчного пузыря после пробного завтрака позволяет судить о его сократительной способности и типе дискинезии (гипокинетический или гиперкинетический). Только у 15% детей функция органа бывает сохранена. Гипокинетический тип дискинезии выявляют у 70%, гиперкинетический — у 15% больных.
ЭРХПГ ЭРХПГ, служащую одним из ведущих методов диагностики состояния жёлчного пузыря, внутри- и внепечёночных жёлчных ходов и обнаружения в них конкрементов, только недавно начали широко применять в педиатрии. ЭРХПГ в обязательном порядке выполняют детям с обтурацион-ным синдромом в анамнезе, детям, у которых при УЗИ возникает подозрение на расширение общего жёлчного протока, а также при подозрении на наличие конкрементов в магистральных жёлчных протоках. При ЭРХПГ, так же как при УЗИ, редко выявляют конкременты в крупных протоках с нарушением пассажа жёлчи по общему печёночному и общему жёлчному протокам, как и патологию большого дуоденального сосочка. В то же время у 85% больных обнаруживают изменения и деформацию жёлчного пузыря, причём у 45% они сочетаются с гипоплазией и фиброзом пузырного протока. Из этой группы у 70% детей при ЭРХПГ выявляют перегиб или перетяжку в области шейки в сочетании с гипоплазией и фиброзом пузырного протока.
Морфологическое исследование При проведении морфологического исследования жёлчного пузыря, удалённого у ребёнка с хроническим калькулёзным холециститом, всегда обнаруживают продуктивную воспалительную реакцию — диффузное распространение клеточного инфильтрата, состоящего из лимфоцитов и плазмоцитов. В 50% препаратов отмечают признаки обострения процесса. В большинстве случаев обнаруживают также анатомические изменения в области шейки и нарушения моторики жёлчного пузыря.
Лечение Консервативная терапия при желчнокаменной болезни длительная и Малоэффективная. Операция выбора при хроническом калькулёзном х°лецистите — холецистэктомия. В детском возрасте, как и у взрослых больных, при выполнении холецистэктомии традиционным доступом применяются довольно травматичные разрезы передней брюшной стенки. В настоящее время лапароскопическую холецистэктомию, характеризующуюся большей безопасностью и высокой эффективностью, считают «золотым стандартом» хирургического лечения нео-сложнённого холелитиаза. Преимущества методики лапароскопической холецистэктомии — минимальная операционная травма, отличная визуализация анатомических структур и всех этапов операции, менее выраженный болевой синдром и меньшее количество послеоперационных и спаечных осложнений, сокращение сроков госпитализации, отличный косметический эффект; особую значимость они приобретают у пациентов детского возраста.
5.15. Портальная гипертензия Портальная гипертензия — повышение давления в сосудах бассейна воротной вены выше 200 мм вод.ст.
Классификация С патофизиологической точки зрения следует отличать (рис. 5-35) портальную гипертензию, при которой паренхима печени находится под воздействием высокого портального давления (паренхиматозная форма), от портальной гипертензии, при которой высокое портальное давление не оказывает непосредственного воздействия на паренхиму печени (непаренхиматозная форма). Сопротивление кровотоку в системе воротной вены может локализоваться над, внутри и под печенью. С этой точки зрения все формы портальной гипертензии разделяют на надпечёночную, внутри-печёночную и внепечёночную.
Этиология и патогенез Портальная гипертензия развивается в результате одновременного взаимодействия двух факторов: нарушения оттока венозной крови из системы воротной вены и увеличения притока крови в систему.
Надпечёночная портальная гипертензия Нарушение венозного оттока от печени (синдром Бадда-Киари, веноокклюзионная болезнь) может возникать в результате порока развития, тромбоза нижней полой или печёночных вен. Портальная гипертензия и нарушение функции печени развиваются вследствие венозного застоя в печени. Внутрипечёночная портальная гипертензия Любое хроническое заболевание печени, приводящее к фиброзу или циррозу, может стать причиной внутрипечёночной портальной гипертензии. При большинстве вариантов цирроза узлы регенерации затрудняют отток крови от синусоидов, приводя к постсинусоидальной обструкции. Наиболее частые причины внутрипечёночной портальной гипертензии — постнекротический цирроз, последствия перенесённого вирусного гепатита, атрезия жёлчных путей, болезнь Уилсона, дефицит а,-антитрипсина и др. Как правило, развитие портальной гипертензии сопровождается признаками дисфункции печени — желтухой, асцитом, задержкой развития ребёнка и др.
Внепечёночная портальная гипертензия У подавляющего большинства детей эта форма портальной гипертензии развивается в результате непроходимости воротной вены. Почти у половины детей с внепечёночной портальной гипертензией можно выявить в анамнезе катетеризацию пупочной вены в период новорождённое™, омфалит, внутрибрюшные инфекции, сепсис или дегидратацию. Однако у половины детей точный этиологический фактор не может быть выявлен. Непроходимость воротной вены сопровождается развитием сети коллатералей в воротах печени, получившей название «кавернозной трансформации воротной вены». Такие же венозные колла-терали развиваются вне печени. К ним относят расширенные вены толстой кишки, а также вены, расположенные около селезёнки и в забрюшинном пространстве. По ним кровь из бассейна воротной вены в обход печени возвращается в сердце (рис. 5-36). Наиболее опасны из этих коллатералей варикозно расширенные вены пищевода и желудка. Они становятся причиной рецидивирующих кровотечений. При врождённом фиброзе печени портальная гипертензия развивается в результате пресинусоидального блока. При этом заболевании портальные тракты увеличиваются за счёт разрастания соединительной ткани и пролиферации жёлчных ходов. При этом типе фиброза синтетическая функция печени остаётся практически неизменной. У детей чаще встречают внепечёночную форму портальной гипертензии.
Клинические проявления портальной гипертензии в значительной степени однотипны и не зависят от её генеза. Однако при каждом заболевании можно отметить ряд особенностей, помогающих уже клинически выявить форму портальной гипертензии.
Внепечёночная портальная гипертензия При внепечёночной форме первые симптомы повышения давления в системе воротной вены появляются очень рано. К ним следует отнести увеличение размеров живота, необъяснимую диарею, гипертермию неясного генеза, спленомегалию и появление подкожных кровоизлияний на нижних конечностях. При лабораторном исследовании крови обнаруживают признаки панцитопении со снижением количества эритроцитов, лейкоцитов и тромбоцитов (гиперспле-низм). Внезапное кровотечение из вен пищевода и кардии часто бывает первым проявлением внепечёночной портальной гипертензии у внешне здоровых детей. У 80% больных с внепечёночной портальной гипертензией кровотечения появляются в течение первых 6 лет жизни ребёнка. Изменения функциональных показателей печени обычно незначительны или отсутствуют. Асцит у детей с внепечёночной портальной гипертензией появляется только в первые дни После перенесённого кровотечения. Внутрипечёночная портальная гипертензия При внутрипечёночной портальной гипертензии симптомы повышения давления в системе воротной вены наслаиваются на клинические проявления цирроза печени и появляются через 5—7 лет после перенесённого вирусного гепатита. В клинической картине у больных с внутрипечёночной портальной гипертензией на первое место выходят симптомы поражения печени. Больные жалуются на слабость, повышенную утомляемость, похудание, боли в животе, чувство тяжести в эпигастральной области, диспептические явления, повышенную кровоточивость. Размеры и консистенция печени зависят от стадии заболевания. В начальных стадиях печень умеренно увеличена в размерах, плотная, поверхность её гладкая. В поздних стадиях заболевания печень обычно не увеличена, нередко даже уменьшена, очень плотная, с бугристой поверхностью. В большинстве случаев выявляют увеличение селезёнки различной степени выраженности с развитием признаков гиперспленизма. При лабораторных исследованиях обнаруживают нарушение функций печени — гипербилирубинемию с преобладанием прямой фракции билирубина, уменьшение количества белка сыворотки крови со снижением альбумин-глобулинового коэффициента, снижение антитоксической функции печени. Однако изменение этих показателей не всегда идёт параллельно развитию портальной гипертензии, что связано с большими компенсаторными возможностями печени и неспецифичностью так называемых печёночных проб. Проявления внутрипечёночной портальной гипертензии — асцит и кровотечения из вен пищевода и кардии — возникают, как правило, при достижении больным подросткового возраста.
Диагностика Диагноз портальной гипертензии может быть установлен на основании УЗИ брюшной полости и допплерографии висцеральных вен. Характерные признаки внепечёночной портальной гипертензии — кавернозная трансформация воротной вены и нормальная структура печени. При паренхиматозной портальной гипертензии печень уплотнена, воротная вена хорошо проходима. При надпечёночной портальной гипертензии отмечают непроходимость печёночных вен или нижней полой вены. При допплерографии при всех формах порталь ной гипертензии отмечают значительное снижение средней скорости кровотока в висцеральных венах. Для паренхиматозных форм портальной гипертензии характерен гипердинамический тип висцерального кровообращения. При ФЭГДС у детей с портальной гипертензией обнаруживают ва-рикозно расширенные вены пищевода и кардиального отдела желудка, а также признаки гипертензионной гастропатии. Вены пищевода и кардии бывают практически единственными источниками кровотечений у детей с портальной гипертензией. Кровотечения из других вен ЖКТ у детей возникают исключительно редко. В сомнительных случаях или при планировании хирургического лечения необходимо проведение висцеральной ангиографии (рис. 5-37). Дигитальная субтракционная ангиография даёт наиболее полную информацию об анатомии висцеральных вен.
Лечение Лечение детей с пищеводными кровотечениями в острой стадии включает седативную терапию, введение назогастрального зонда для аспирации желудочного содержимого и инфузионную терапию кри-сталлоидными растворами и препаратами крови в объёме 50% необходимой суточной потребности. Широкое распространение в настоящее время получила эндоскопическая склеротерапия или эндоскопическое лигирование вен пищевода и кардии. Основная задача хирургического лечения портальной гипертензии — ликвидация и предотвращение кровотечений из варикозных вен пищевода и желудка. Резко выраженная спленомегалия или выраженный гиперспленизм могут быть отдельными показаниями к манипуляциям на селезёнке. У детей с паренхиматозной портальной гипертензией показанием к хирургическому лечению может быть асцит, резистентный к консервативной терапии. Современные методы оперативного лечения портальной гипертензии у детей включают выполнение различных портосистемных анастомозов или операций, непосредственно воздействующих на варикозные вены пищевода и желудка. Методы лечения портальной гипертензии значительно различаются в зависимости от формы заболевания, наличия и выраженности пищеводных кровотечений, а также уровня подготовки специалистов лечебного учреждения, где больной проходит курс лечения. Идеальной для детей с внепечёночной формой портальной гипертензии можно считать операцию мезопортального шунтирования, после которой наряду с нормализацией давления в системе воротной вены происходит восстановление портального кровообращения (рис. 5-38). Для ликвидации спленомегалии и гиперспленизма в настоящее время используют эндоваскулярную эмболизацию паренхимы органа вместо спленэктомии. Единственный метод лечения терминальных стадий цирроза печени — трансплантация печени.
5.16. Заболевания селезёнки К этой группе относят системные заболевания, в патогенезе которых селезёнка играет ведущую роль, и собственно заболевания селезёнки (аномалии развития, кисты, повреждения органа). Из системных
5.16.1. Наследуемый микросфероцитоз (семейная гемолитическая анемия Минковского-Шоффара) Наследуемый сфероцитоз — гемолитическая анемия, возникающая вследствие дефекта клеточной мембраны эритроцитов. Проницаемость мембраны для ионов натрия становится чрезмерной, в связи с чем эритроциты приобретают шарообразную форму, становятся ломкими и легко подвергаются спонтанному гемолизу. Генетические аспекты. Врождённые дефекты белков мембраны эРитроцита: • тип I — дефект гена Р-спектрина (* 182870, 14q22-q23.2, ген SPTB, 91); • тип II — дефект гена анкирина (* 182900, 8р11.2, ген ANK1, 9*); • тип III (ША) — дефект гена ос-спектрина (*270970, lq21, ген SPTA1, Р). Клиническая картина и диагностика Заболевание характеризуется триадой симптомов: желтухой, анемией, спленомегалией. Степень их выраженности различна. Заболевание может протекать в течение длительного времени в скрытой форме, при которой основной симптом болезни — анемия — отсутствует. Анемия лёгкой или умеренной степени (НЬ 80—100 г/л) сохраняется как постоянный симптом или становится более выраженной (НЬ 58-66 г/л) в период интенсивного разрушения эритроцитов, который принято называть гемолитическим кризом. Частый симптом заболевания — желтуха, связанная с увеличением содержания непрямого билирубина в крови, количество которого в результате усиленного распада эритроцитов становится слишком большим. Клетки печени не успевают перевести в прямой билирубин часть непрямого, и он накапливается в крови. Желтуха обычно не влияет на общее состояние больных. Размеры селезёнки варьируют в довольно широких пределах, что зависит от интенсивности гемолиза и длительности заболевания. Чаще выявляют умеренное увеличение печени. Печень у больных гемолитической анемией постоянно выделяет большое количество густой жёлчи, что создаёт условия для образования конкрементов в жёлчи и жёлчных ходах. Моча тёмная. Кал в большинстве случаев окрашен избыточно. Общее состояние больных в начальных стадиях заболевания нарушается мало. Дети отстают в росте и развитии. У заболевших в раннем детском возрасте может произойти преждевременное окостенение черепа. Для таких больных характерны башенный череп, микрофтальмия, высокое нёбо, седловидный нос, вы-ступание верхней челюсти. Очередные приступы желтухи при семейной микросфероцитарной анемии провоцируются, как правило, различными инфекциями и сопровождаются повышением температуры тела, кровотечениями из носа, ухудшением общего состояния. Каждый новый криз сопровождается дальнейшим увеличением селезёнки, которая при пальпации имеет гладкую поверхность, плотна и не очень болезненна. Существенное значение при установлении диагноза имеют семейный анамнез, наличие заболевания у других членов семьи. Выявление анемии, желтухи за счёт преобладания непрямого билирубина, спленомегалии, ретикулоцитоза и сниженной осмотической резистентности эритроцитов может помочь при установлении диагноза. На высоте криза осмотическая резистентность эритроцитов может при- ближаться к норме, а микросфероцитоз отсутствовать в связи с тем, что гемолизу прежде всего подвергаются эритроциты с наиболее низкой осмотической резистентностью и сфероциты. Увеличение количества ретикулоцитов, полихроматофильных эритроцитов и нормоб-ластов связано с усиленными регенеративными процессами в костном мозге. Прекращение криза характеризуется уменьшением количества ретикулоцитов, отчётливым микросфероцитозом и снижением осмотической резистентности эритроцитов.
При врождённой семейной гемолитической анемии лечение в основном хирургическое — спленэктомия (метод выбора). Эффект спленэктомии появляется быстро, так как с удалением селезёнки исчезают условия для усиленного гемолиза эритроцитов. Продолжительность жизни эритроцитов быстро приходит к норме (до 100 дней, в то время как до операции составляет 10—18 дней). Возможна также эмболизация селезёночной артерии с целью исключения функционирования селезёнки или лапароскопическое удаление этого органа.
5.16.2. Приобретённая гемолитическая анемия Воздействие на организм в процессе жизнедеятельности различных факторов (физических, химических, вирусных, бактериальных, лекарственных и др.) может привести к образованию антиэритроци-тарных аутоантител, вызывающих агглютинацию и гемолиз эритроцитов больного. Выявить антитела помогает реакция Кумбса с анти-глобулиновой сывороткой. При положительной реакции происходит связывание блокированных эритроцитов. Клиническая картина и диагностика Приобретённая гемолитическая анемия во многом сходна по течению с врождённой микросфероцитарной гемолитической анемией: Цикличность желтухи, увеличение селезёнки, непрямая гипербилиру-бинемия, уробилинурия, анемия, ретикулоцитоз, эритробластическая Реакция костного мозга, ухудшение состояния больного и повышение температуры тела во время криза. Вместе с тем приобретённая гемолитическая анемия отличается большей тяжестью клинических проявлений, небольшим понижением или нормальными цифрами осмотической резистентности эритроцитов, часто макроцитозом, а не микроцитозом, а также нередко положительной реакцией Кумбса. Прогноз при этой форме анемии тяжелее, чем при врождённой.
Лечение Лечение направлено прежде всего на устранение причинного фактора (если он известен), а затем на снижение реактивности организма и создание препятствий к синтезу антител. Этого достигают применением глюкокортикоидов (кортизона, преднизолона, триамциноло-на, дексаметазона и др.), подавляющих образование антител в селезёнке и лимфоидной ткани. В случае неэффективности гормональной терапии и прогрессивного ухудшения состояния больного, нарастания анемии и явлений гиперспленизма показана спленэктомия. Таким больным до и после операции назначают глюкокортикоидную терапию. Непосредственные и отдалённые результаты спленэктомии при приобретённых аутоиммунных формах гемолитической анемии хуже, чем при врождённых.
5.16.3. Врождённая (семейная) Клиническая картина сходна с таковой при микросфероцитарной гемолитической анемии. Однако микросфероцитоз отсутствует, осмотическая резистентность эритроцитов, как правило, не изменена. Различают две формы врождённой несфероцитарной гемолитической анемии — анемию с нормальным или незначительно увеличенным диаметром эритроцитов и анемию с выраженным макроцитозом. У больных первой группы спленэктомия обычно улучшает состояние. При выраженном макроцитозе спленэктомия неэффективна, в связи с чем показано консервативное лечение.
5.16.4. Тромбоцитопеническая пурпура Болезнь Верльхофа характеризуется появлением кожных и подкожных кровоизлияний и кровотечений из слизистых оболочек различных органов. Этиология и патогенез В патогенезе заболевания можно говорить о провоцирующем действии инфекционных заболеваний, гипо- и авитаминозов, различных нейрогуморальных и эндокринных влияний. Широкое распространение получила аутоиммунная теория патогенеза, согласно которой тромбоцитопения возникает вследствие появления в крови антитромбоцитарных аутоантител, повреждающих тромбоциты. Тромбоцитопения в периферической крови, по современным представлениям, бывает следствием патологии их родоначальных клеток — мегакариоцитов (нарушение их созревания и процессов отшнуровки тромбоцитов, укорочение сроков их жизни). В патогенезе повышенной кровоточивости при болезни Верль-хофа кроме тромбоцитопении участвуют изменения в сосудистой стенке в виде повышения её проницаемости, резистентности и кон-трактильных свойств. Нарушения свёртывания крови связаны с тром-боцитарным фактором (снижаются тромбопластическая активность, тест генерации тромбопластина, нарушается ретракция кровяного сгустка, увеличиваются показатели фибринолитической активности крови). Селезёнка при тромбоцитопенической пурпуре — источник образования антител, орган разрушения тромбоцитов, ингибитор тромбоцитопоэза.
Клиническая картина и диагностика Жалобы детей, страдающих болезнью Верльхофа, сводятся к слабости, быстрой утомляемости, повышению температуры тела до суб-фебрильных цифр (иногда). При осмотре обращает на себя внимание большое количество полиморфных кожных высыпаний, подкожных кровоизлияний, самых разнообразных по размерам (от мелких петехий до обширных геморрагии) и окраске. Кровоизлияния располагаются преимущественно на передней поверхности тела. Часто их обнаруживают на слизистой оболочке зева, полости рта, глотки. Обычно кровоизлияния появляется без видимой причины, иногда им предшествует травма. У неко-т°рых больных возникают подкожные гематомы различных размеров. Реже бывают кровавая рвота и чёрный стул за счёт проглоченной кро-Ви- Иногда происходят кровоизлияния в область корня брыжейки и по ходу пищеварительного тракта. У девочек могут быть метрор-Рагии. Начало заболевания в этих случаях совпадает с появлением первых менструаций. Возможны кровоизлияния в глазное дно и стекловидное тело с клинической картиной временной потери зрения. Кровоизлияния в ЦНС обусловливают картину эпилепсии, менингита, очаговых расстройств. Описаны случаи кровавого пота и кровавых слёз. При исследовании внутренних органов особых изменений, как правило, не находят. Селезёнка обычно не увеличена или увеличена незначительно. При уточнении диагноза тромбоцитопенической пурпуры первостепенное значение имеют лабораторные исследования крови. Для больных, страдающих болезнью Верльхофа, характерны тромбо-цитопения, увеличение времени кровотечения по Дьюку (вместо 3 мин до 10 мин и более), значительное снижение или отсутствие ретракции кровяного сгустка. Свёртываемость крови не нарушена (в отличие от гемофилии). Осмотическая резистентность эритроцитов остаётся неизменной в периоде ремиссий и может быть понижена во время кровотечения. Характерен ретикулоцитоз (до 40%), особенно во время кровотечений. В миелограмме активация красного и белого ростков крови. Количество мегакариоцитов в одних случаях понижено, в других, наоборот, повышено. Количество пластинок может быть нормальным, но отшнуровывание и выход их в кровоток замедлены. Среди клинических тестов большое значение имеют пробы на проницаемость (ломкость) капилляров — положительные симптомы «жгута», «щипка» и др. При капилляроскопии находят спазм или атонию мелких сосудов, их разрыв, периваскуляр-ные инфильтраты. Дифференцировать тромбоцитопеническую пурпуру необходимо от апластической анемии, системных заболеваний крови, геморрагического васкулита, гемофилии. По клиническому течению различают острые (подострые) и хронические (непрерывные и рецидивирующие) формы болезни. К хроническим относят случаи заболевания с длительностью течения более 6 мес; при этом наблюдают чередование периодов обострения болезни с ремиссиями различной длительности.
Лечение Положительные результаты лечения болезни Верльхофа удаётся получить с помощью введения глюкокортикоидных препаратов. Чаще других применяют преднизолон в суточной дозе 1-2 мг на 1 кг массы тела больного, триамцинолон и дексаметазон. Продолжительность курса лечения составляет от 1 до 3 мес и более в зависимости от течения заболевания. Гормональная терапия способствует не только увеличению количества тромбоцитов, но и укреплению стенок кровеносных сосудов. Кроме того, при иммунных формах заболевания гормонотерапия подавляет образование антител в клетках ретикуло-эндотелиальной системы. Местно для остановки кровотечения из полости рта, дёсен, носа, глотки применяют тампонаду гемостатической губкой, марлей, смоченной раствором тромбина или перекисью водорода. Тампоны оставляют на несколько часов. При неэффективности консервативной терапии показана сплен-эктомия. Её выполняют при хронических и рецидивирующих формах болезни
|