Строение атома и Периодическая система химических элементов
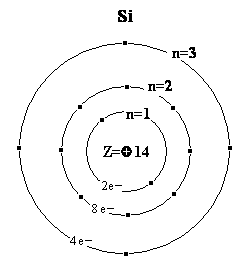
Согласно современным представлениям атом представляет собой сложную микросистему, состоящую из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг этого ядра. Заряд ядра Z равен порядковому номеру элемента в Периодической системе химических элементов. Например, заряд ядра атома водорода равен +1, поэтому водород – первый элемент Периодической системы; заряд ядра атома углерода равен +6 (углерод – шестой по счёту элемент в периодической системе). Химический элемент– этовид атомов, характеризующийся определённым зарядом ядра. Ядра всех атомов данного элемента имеют один и тот же заряд. Поскольку атом электронейтрален, то число электронов (отрицательных частиц) в атоме равно положительному заряду ядра: в атоме водорода (Z = +1) содержится только один электрон, в атоме углерода (Z = +6) – шесть электронов, в атоме железа (Z = +28) – двадцать восемь электронов. Электроны в многоэлектронных атомах располагаются на нескольких электронных слоях (уровнях), находящихся на различных расстояниях от ядра атома. Чем больше энергия электрона, тем дальше он находится от ядра. Если несколько электронов имеют близкие значения энергии, то они (электроны) находятся на приблизительно одинаковом расстоянии от ядра. Так образуются электронные оболочки, состоящие из электронов с приблизительно одинаковой энергией. Можно также сказать, что электроны с близкими значениями энергии образуют электронный слой, или, как часто говорят, энергетический уровень. Число электронных слоёв в атоме данного элемента равно номеру периода, в котором находится элемент. Например, кремний (Z = +14) – элемент третьего периода; все 14 электронов, содержащиеся в атоме кремния, располагаются на трёх энергетических уровнях: на первом энергетическом уровне (n = 1) – 2 электрона, на втором (n = 2) – 8 электронов, на третьем – 4 электрона (рисунок 1.1).
Рисунок 1.1 – Строение атома кремния
Рисунок 1.2 – Формы и обозначения атомных орбиталей
На одной орбитали может находиться не более двух электронов, причём спины этих электронов должны быть противоположны. Первый энергетический уровень любого атома образован одной s-орбиталью
Рисунок 1.3 – Расположение p-электронных облаков в пространстве
В пределах одного и того же энергетического уровня p-орбитали имеют несколько более высокую энергию, чем s-обитали. Поэтому p-орбитали показывают чуть выше s-орбиталей. На четырёх орбиталях второго энергетического уровня может разместиться не более 8 электронов, поэтому максимальное число электронов на втором энергетическом уровне любого атома равно 8.
|

 Атомной орбиталью называют область пространства вокруг ядра атома, в которой наиболее вероятно нахождение электрона (иногда вместо термина «атомная орбиталь» используют термин «электронное облако»). Орбитали в зависимости от энергии электронов имеют различные формы и размеры (рисунок 1.2):
Атомной орбиталью называют область пространства вокруг ядра атома, в которой наиболее вероятно нахождение электрона (иногда вместо термина «атомная орбиталь» используют термин «электронное облако»). Орбитали в зависимости от энергии электронов имеют различные формы и размеры (рисунок 1.2):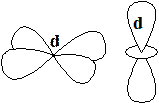

 Графически орбиталь изображают в виде клеточки, а электрон – в виде стрелки. Орбиталь атома водорода с его единственным электроном:
Графически орбиталь изображают в виде клеточки, а электрон – в виде стрелки. Орбиталь атома водорода с его единственным электроном: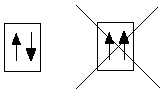 Кроме движения вокруг ядра каждый электрон обладает собственным движением. Это собственное движение электрона (аналогия из классической механики – вращение частицы вокруг своей оси) характеризуют с помощью понятия спин (обозначение спина: или ¯).
Кроме движения вокруг ядра каждый электрон обладает собственным движением. Это собственное движение электрона (аналогия из классической механики – вращение частицы вокруг своей оси) характеризуют с помощью понятия спин (обозначение спина: или ¯). . Т.к. на одной орбитали может разместиться максимум
. Т.к. на одной орбитали может разместиться максимум 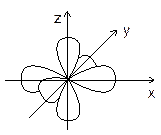
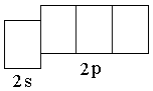 Второй энергетический уровень любого атома состоит из одной 2s-орбитали, образующей s-подуровень и трёх 2p-орбиталей, образующих p-подуровень; три p-электронных облака расположены в пространстве перпендикулярно друг другу (рисунок 1.3).
Второй энергетический уровень любого атома состоит из одной 2s-орбитали, образующей s-подуровень и трёх 2p-орбиталей, образующих p-подуровень; три p-электронных облака расположены в пространстве перпендикулярно друг другу (рисунок 1.3).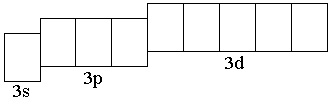 Третий энергетический уровень образован одной
Третий энергетический уровень образован одной 


