Модель ідеального газу, яка використовується в молекулярно-кінетичній теорії газів, дає змогу описувати поведінку розріджених газів при достатньо високих температурах і низьких тисках. Виводячи рівняння стану ідеального газу, нехтують при цьому розмірами молекул і їх взаємодію одна з одною.
Підвищення тиску приводить до зменшення середньої відстані між молекулами, і тому потрібно враховувати об’єм молекул і взаємодію між ними.
Розглядаючи реальні гази – гази, властивості яких залежать від взаємодії молекул, треба враховувати сили міжмолекулярної взаємодії. Вони проявляються на відстані 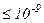 м і швидко зменшуються при збільшенні відстані між молекулами. Такі сили – короткосяжні.
м і швидко зменшуються при збільшенні відстані між молекулами. Такі сили – короткосяжні.
 Між молекулами одночасно діють сили притягання і сили відштовхування. На відстані
Між молекулами одночасно діють сили притягання і сили відштовхування. На відстані 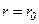 результуюча сила
результуюча сила 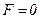 . Відстань
. Відстань  відповідає рівноважній відстані між молекулами, на якій би вони знаходились за відсутності теплового руху. Якщо
відповідає рівноважній відстані між молекулами, на якій би вони знаходились за відсутності теплового руху. Якщо 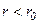 , то переважають сили відштовхування
, то переважають сили відштовхування  , якщо
, якщо 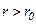 – сили притягання
– сили притягання 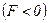 (рис. 88).
(рис. 88).
Елементарна робота  сили F при збільшенні відстані між молекулами на dr виконується за рахунок зменшення взаємної потенціальної енергії молекул:
сили F при збільшенні відстані між молекулами на dr виконується за рахунок зменшення взаємної потенціальної енергії молекул: 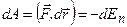 . Якщо молекули знаходяться на відстані, коли молекулярні сили не діють
. Якщо молекули знаходяться на відстані, коли молекулярні сили не діють 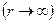 , то
, то 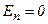 . При зближенні молекул появляються сили притягання, які виконують додатну роботу. Потенціальна енергія взаємодії зменшується, досягаючи мінімуму при
. При зближенні молекул появляються сили притягання, які виконують додатну роботу. Потенціальна енергія взаємодії зменшується, досягаючи мінімуму при 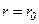 . Якщо
. Якщо 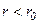 , то із зменшенням
, то із зменшенням 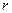 сили відштовхування
сили відштовхування 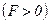 різко зростають і робота, яка виконується проти цих сил, від’ємна
різко зростають і робота, яка виконується проти цих сил, від’ємна 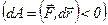 . Потенціальна енергія також різко зростає і стає додатною. Отже, система із двох молекул, що взаємодіють між собою, у стані стійкої рівноваги
. Потенціальна енергія також різко зростає і стає додатною. Отже, система із двох молекул, що взаємодіють між собою, у стані стійкої рівноваги 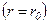 характеризується мінімальною потенціальною енергією.
характеризується мінімальною потенціальною енергією.
Механізм співударяння молекул реальних газів не містить прямого пружного удару, як це приймалось при розгляді молекул ідеального газу. Взаємодія реальних молекул відбувається на відстані, і молекули не наближаються до дотику.
Радіус молекул більшості газів порядку 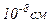 , отже, об’єм молекули порядку
, отже, об’єм молекули порядку 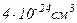 . В одному
. В одному 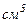 газу при нормальних умовах міститься
газу при нормальних умовах міститься  молекул. Отже, власний об’єм всіх молекул в
молекул. Отже, власний об’єм всіх молекул в 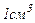 при нормальних умовах
при нормальних умовах 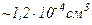 , тобто
, тобто 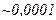 від об’єму, зайнятого газом. При тиску
від об’єму, зайнятого газом. При тиску 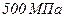 об’єм молекул становить уже половину всього об’єму газу.
об’єм молекул становить уже половину всього об’єму газу.
Отже, для реальних газів необхідно враховувати розміри молекул і їх взаємодію одна з одною, тому модель ідеального газу і рівняння Клапейрона-Менделєєва 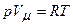 (для моля газу), яке описує ідеальний газ, для реальних газів непридатне.
(для моля газу), яке описує ідеальний газ, для реальних газів непридатне.

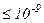 м і швидко зменшуються при збільшенні відстані між молекулами. Такі сили – короткосяжні.
м і швидко зменшуються при збільшенні відстані між молекулами. Такі сили – короткосяжні. Між молекулами одночасно діють сили притягання і сили відштовхування. На відстані
Між молекулами одночасно діють сили притягання і сили відштовхування. На відстані 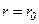 результуюча сила
результуюча сила 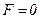 . Відстань
. Відстань  відповідає рівноважній відстані між молекулами, на якій би вони знаходились за відсутності теплового руху. Якщо
відповідає рівноважній відстані між молекулами, на якій би вони знаходились за відсутності теплового руху. Якщо 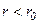 , то переважають сили відштовхування
, то переважають сили відштовхування  , якщо
, якщо 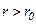 – сили притягання
– сили притягання 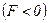 (рис. 88).
(рис. 88). сили F при збільшенні відстані між молекулами на dr виконується за рахунок зменшення взаємної потенціальної енергії молекул:
сили F при збільшенні відстані між молекулами на dr виконується за рахунок зменшення взаємної потенціальної енергії молекул: 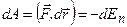 . Якщо молекули знаходяться на відстані, коли молекулярні сили не діють
. Якщо молекули знаходяться на відстані, коли молекулярні сили не діють 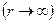 , то
, то 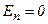 . При зближенні молекул появляються сили притягання, які виконують додатну роботу. Потенціальна енергія взаємодії зменшується, досягаючи мінімуму при
. При зближенні молекул появляються сили притягання, які виконують додатну роботу. Потенціальна енергія взаємодії зменшується, досягаючи мінімуму при 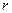 сили відштовхування
сили відштовхування 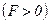 різко зростають і робота, яка виконується проти цих сил, від’ємна
різко зростають і робота, яка виконується проти цих сил, від’ємна 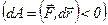 . Потенціальна енергія також різко зростає і стає додатною. Отже, система із двох молекул, що взаємодіють між собою, у стані стійкої рівноваги
. Потенціальна енергія також різко зростає і стає додатною. Отже, система із двох молекул, що взаємодіють між собою, у стані стійкої рівноваги 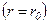 характеризується мінімальною потенціальною енергією.
характеризується мінімальною потенціальною енергією.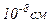 , отже, об’єм молекули порядку
, отже, об’єм молекули порядку 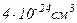 . В одному
. В одному 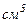 газу при нормальних умовах міститься
газу при нормальних умовах міститься  молекул. Отже, власний об’єм всіх молекул в
молекул. Отже, власний об’єм всіх молекул в 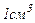 при нормальних умовах
при нормальних умовах 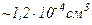 , тобто
, тобто 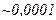 від об’єму, зайнятого газом. При тиску
від об’єму, зайнятого газом. При тиску 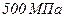 об’єм молекул становить уже половину всього об’єму газу.
об’єм молекул становить уже половину всього об’єму газу.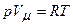 (для моля газу), яке описує ідеальний газ, для реальних газів непридатне.
(для моля газу), яке описує ідеальний газ, для реальних газів непридатне.


