Внутрішня енергія реального газу дорівнює сумі кінетичної енергії 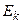 теплового руху його молекул і потенціальної енергії
теплового руху його молекул і потенціальної енергії 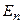 міжмолекулярної взаємодії. Потенціальна енергія реального газу, який описується рівнянням Ван-дер-Ваальса, зумовлена лише силами притягання між молекулами, які приводять до виникнення внутрішнього тиску на газ
міжмолекулярної взаємодії. Потенціальна енергія реального газу, який описується рівнянням Ван-дер-Ваальса, зумовлена лише силами притягання між молекулами, які приводять до виникнення внутрішнього тиску на газ
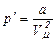 .
.
Робота, яка затрачається для подолання сил притягання, що діють між молекулами газу, або проти внутрішнього тиску, йде на збільшення потенціальної енергії системи:
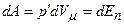 , або
, або 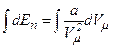 .
.
Звідси
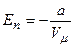 .
.
Знак „–” означає, що молекулярні сили, які створюють внутрішній тиск 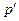 , є силами притягання.
, є силами притягання.
З достатнім ступенем точності можна вважати, що кінетична енергія 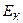 для одного моля реального газу дорівнює кінетичній енергії ідеального газу, що перебуває при тій самій температурі. Внутрішня енергія
для одного моля реального газу дорівнює кінетичній енергії ідеального газу, що перебуває при тій самій температурі. Внутрішня енергія 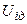 ідеального газу дорівнює тільки кінетичній енергії хаотичного руху молекул. Тому
ідеального газу дорівнює тільки кінетичній енергії хаотичного руху молекул. Тому
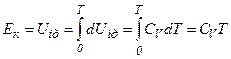 .
.
Тоді внутрішня енергія одного моля реального газу:
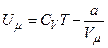
і вона росте із збільшенням температури та об’єму газу.
Якщо газ розширюється без теплообміну з навколишнім середовищем 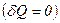 і не виконує зовнішньої роботи
і не виконує зовнішньої роботи 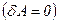 , то на основі першого закону термодинаміки
, то на основі першого закону термодинаміки  , отримуємо, що
, отримуємо, що 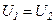 .
.
При адіабатному розширенні без виконання зовнішньої роботи внутрішня енергія газу не міняється.
Для ідеального газу 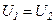 означає рівність температур
означає рівність температур  , тобто при адіабатному розширенні ідеального газу у вакуумі його температура не змінюється.
, тобто при адіабатному розширенні ідеального газу у вакуумі його температура не змінюється.
Для реального газу:
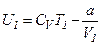 і
і  .
.
З умови 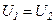 отримуємо
отримуємо
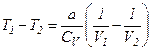 .
.
Оскільки 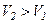 , то
, то 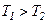 , тобто реальний газ при адіабатному розширенні у вакуум охолоджується. При адіабатному стиску реальний газ нагріватиметься.
, тобто реальний газ при адіабатному розширенні у вакуум охолоджується. При адіабатному стиску реальний газ нагріватиметься.

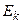 теплового руху його молекул і потенціальної енергії
теплового руху його молекул і потенціальної енергії 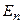 міжмолекулярної взаємодії. Потенціальна енергія реального газу, який описується рівнянням Ван-дер-Ваальса, зумовлена лише силами притягання між молекулами, які приводять до виникнення внутрішнього тиску на газ
міжмолекулярної взаємодії. Потенціальна енергія реального газу, який описується рівнянням Ван-дер-Ваальса, зумовлена лише силами притягання між молекулами, які приводять до виникнення внутрішнього тиску на газ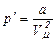 .
.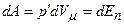 , або
, або 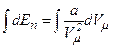 .
.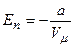 .
.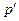 , є силами притягання.
, є силами притягання.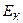 для одного моля реального газу дорівнює кінетичній енергії ідеального газу, що перебуває при тій самій температурі. Внутрішня енергія
для одного моля реального газу дорівнює кінетичній енергії ідеального газу, що перебуває при тій самій температурі. Внутрішня енергія 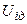 ідеального газу дорівнює тільки кінетичній енергії хаотичного руху молекул. Тому
ідеального газу дорівнює тільки кінетичній енергії хаотичного руху молекул. Тому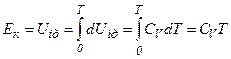 .
.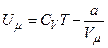
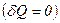 і не виконує зовнішньої роботи
і не виконує зовнішньої роботи 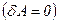 , то на основі першого закону термодинаміки
, то на основі першого закону термодинаміки  , отримуємо, що
, отримуємо, що 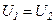 .
. , тобто при адіабатному розширенні ідеального газу у вакуумі його температура не змінюється.
, тобто при адіабатному розширенні ідеального газу у вакуумі його температура не змінюється.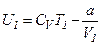 і
і  .
.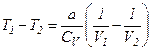 .
.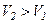 , то
, то 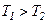 , тобто реальний газ при адіабатному розширенні у вакуум охолоджується. При адіабатному стиску реальний газ нагріватиметься.
, тобто реальний газ при адіабатному розширенні у вакуум охолоджується. При адіабатному стиску реальний газ нагріватиметься.


