Для дослідження поведінки реального газу розглянемо ізотерми Ван-дер-Ваальса для одного моля, які визначаються рівнянням:
 .
.
Перетворимо це рівняння до вигляду:
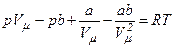
і
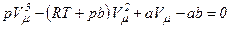 .
.
Отримане рівняння є алгебраїчним рівнянням третього ступеня відносно молярного об’єму. Коефіцієнти рівняння залежать від тиску, температури і хімічної природи газу. Залежно від числових значень p і T для даного газу це рівняння може мати або три дійсні корені або один дійсний і два уявні, причому фізичний зміст мають лише дійсні додатні корені. Ізотерми газу, які описуються рівнянням Ван-дер-Ваальса, мають вигляд, наведений на рис. 91, де  .
.
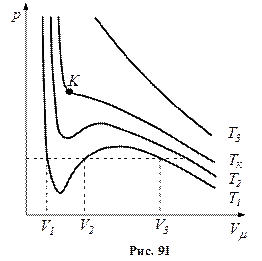
При температурах 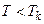 є область станів, де кожному значенню тиску відповідають три точки ізотерми й ізотерма має хвилястоподібну ділянку. При підвищенні температури ці три точки зближуються і при
є область станів, де кожному значенню тиску відповідають три точки ізотерми й ізотерма має хвилястоподібну ділянку. При підвищенні температури ці три точки зближуються і при 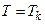 зливаються в одну точку
зливаються в одну точку 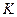 , яка є точкою перегину ізотерми. Дотична до ізотерми в точці
, яка є точкою перегину ізотерми. Дотична до ізотерми в точці 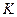 паралельна до осі абсцис. При температурах
паралельна до осі абсцис. При температурах 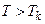 ізотерми Ван-дер-Ваальса близькі до ізотерми ідеального газу.
ізотерми Ван-дер-Ваальса близькі до ізотерми ідеального газу.
Розглянемо ізотерми при 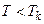 (рис. 92). На ділянках
(рис. 92). На ділянках 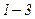 і
і 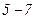 при зменшенні об’єму V зростає тиск p, що відповідає експерименту. Частина ізотерми
при зменшенні об’єму V зростає тиск p, що відповідає експерименту. Частина ізотерми  відповідає газоподібному стану, а частина
відповідає газоподібному стану, а частина 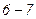 – рідині.
– рідині.
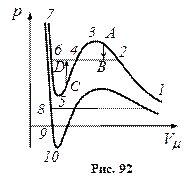
На ділянці 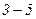 стискання речовини приводить до зменшення тиску p. У природі немає і не може бути таких речовин, в яких із збільшенням тиску p об’єм не зменшується, а зростає. Стан речовини з такими властивостями повинен бути дуже нестійким. Справді, уявимо собі, що такий стан якось реалізовано і нехай в якійсь частині такої речовини з випадкових причин як завгодно мало збільшився тиск. Такі випадкові невеликі зміни не тільки можливі, а й неминучі (флюктуації). Тоді це
стискання речовини приводить до зменшення тиску p. У природі немає і не може бути таких речовин, в яких із збільшенням тиску p об’єм не зменшується, а зростає. Стан речовини з такими властивостями повинен бути дуже нестійким. Справді, уявимо собі, що такий стан якось реалізовано і нехай в якійсь частині такої речовини з випадкових причин як завгодно мало збільшився тиск. Такі випадкові невеликі зміни не тільки можливі, а й неминучі (флюктуації). Тоді це
збільшення тиску повинно викликати збільшення об’єму, яке у свою чергу спричинить ще значніше збільшення тиску і т.д., доки речовина не перейде до стану, що відповідає точці 3, починаючи з якого, залежність об’єму від тиску стає якісно нормальною.
Як завгодно мале випадкове зменшення тиску p викликає довільний перехід речовини до стану, якому відповідає точка 5.
Експериментальна ізотерма матиме вигляд ламаної лінії 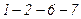 .
.
У станах, що відповідають горизонтальній ділянці 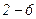 , спостерігається рівновага рідкої і газоподібної фази речовини.
, спостерігається рівновага рідкої і газоподібної фази речовини.
Речовина в газоподібному стані при 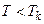 називається парою, а пара, що знаходиться в рівновазі зі своєю рідиною, називається насиченою.
називається парою, а пара, що знаходиться в рівновазі зі своєю рідиною, називається насиченою.
Речовина, стани якої відповідають точкам частини 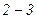 кривої, перебуває в газоподібному стані, тому що частина
кривої, перебуває в газоподібному стані, тому що частина 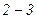 є продовженням гілки
є продовженням гілки  . Але тиск пари в будь-якому з цих станів вищий за пружність насиченої пари при тій самій температурі, а це протиприродно.
. Але тиск пари в будь-якому з цих станів вищий за пружність насиченої пари при тій самій температурі, а це протиприродно.
Стани 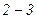 речовини спостерігаються при швидкому охолодженні закритої посудини з повітрям, що містить у собі водяну пару. Треба ретельно очистити повітря від слідів пилу і щоб у ньому не було електричних зарядів. У цих умовах, незважаючи на охолодження, а отже, і зменшення тиску насиченої водяної пари, вона досить довгий час не конденсується, залишаючись в газоподібному стані. Така пара називається перенасиченою. Стани
речовини спостерігаються при швидкому охолодженні закритої посудини з повітрям, що містить у собі водяну пару. Треба ретельно очистити повітря від слідів пилу і щоб у ньому не було електричних зарядів. У цих умовах, незважаючи на охолодження, а отже, і зменшення тиску насиченої водяної пари, вона досить довгий час не конденсується, залишаючись в газоподібному стані. Така пара називається перенасиченою. Стани 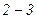 є нестійкими: достатньо, наприклад, в стані А попадання пилинки в пару, щоб вся речовина розпалась на дві фази і перейшла в стан В на прямій
є нестійкими: достатньо, наприклад, в стані А попадання пилинки в пару, щоб вся речовина розпалась на дві фази і перейшла в стан В на прямій 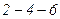 . Стани
. Стани 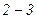 називаються метастабільними.
називаються метастабільними.
Точки на частині ізотерми 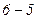 відповідають станам рідини, тому що частина
відповідають станам рідини, тому що частина 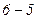 є продовженням гілки
є продовженням гілки  . Ці стани речовини називають перегрітою рідиною. Це рідина, яка зберігається при
. Ці стани речовини називають перегрітою рідиною. Це рідина, яка зберігається при
тисках менших, ніж тиск насиченої пари за даної температури. Стан перегрітої рідини досягається так. Береться дуже чиста рідина без домішок і мікроскопічних бульбашок повітря в об’ємі, що займає рідина. Це досягається тривалим кипінням рідини. Якщо приготовлену таким чином рідину нагрівати, то при досягненні умов переходу від рідкого стану в газоподібний такий перехід не спостерігається. Параметри речовини  відповідають його знаходженню в газоподібному стані, але він існує у вигляді рідини. Якщо в перегріту рідину кинути піщинку, то відбувається швидкий перехід певної частини рідини із рідкого стану в газоподібний по всьому об’єму, який супроводжується бурхливим кипінням рідини. Тиск газу над рідиною зростає до тиску, що відповідає ділянці
відповідають його знаходженню в газоподібному стані, але він існує у вигляді рідини. Якщо в перегріту рідину кинути піщинку, то відбувається швидкий перехід певної частини рідини із рідкого стану в газоподібний по всьому об’єму, який супроводжується бурхливим кипінням рідини. Тиск газу над рідиною зростає до тиску, що відповідає ділянці 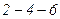 (перехід
(перехід  на рис. 92). Стани
на рис. 92). Стани  – метастабільні.
– метастабільні.
При досить низьких температурах нижня частина ізотерми Ван-дер-Ваальса перетинає вісь 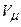 і переходить в область від’ємних тисків. Речовина при від’ємному тиску знаходиться у стані не стиску, а розтягу. Ділянка
і переходить в область від’ємних тисків. Речовина при від’ємному тиску знаходиться у стані не стиску, а розтягу. Ділянка 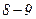 на нижній ізотермі (рис. 92) відповідає перегрітій, а ділянка
на нижній ізотермі (рис. 92) відповідає перегрітій, а ділянка 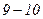 – розтягнутій рідині.
– розтягнутій рідині.
 З рівняння стану Ван-дер-Ваальса не можна визначити положення горизонтальної частини дослідної кривої відносно максимуму і мінімуму кривої Ван-дер-Ваальса (рис. 93). Це означає, що не можна визначити величину рівноважного тиску насиченої пари при даній температурі. Як показав Максвелл, якщо уявити собі перехід від стану 6 до стану 2, то незалежно від того, як він відбувається, вздовж однофазної кривої
З рівняння стану Ван-дер-Ваальса не можна визначити положення горизонтальної частини дослідної кривої відносно максимуму і мінімуму кривої Ван-дер-Ваальса (рис. 93). Це означає, що не можна визначити величину рівноважного тиску насиченої пари при даній температурі. Як показав Максвелл, якщо уявити собі перехід від стану 6 до стану 2, то незалежно від того, як він відбувається, вздовж однофазної кривої 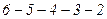 , чи вздовж двофазної прямої
, чи вздовж двофазної прямої  , він повинен супроводжуватися однією і тією ж роботою. Площа під кривою
, він повинен супроводжуватися однією і тією ж роботою. Площа під кривою 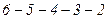 повинна дорівнювати площі під прямою
повинна дорівнювати площі під прямою  , оскільки робота на діаграмі
, оскільки робота на діаграмі 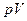 дорівнює площі під відповідними діаграмами. Звідси, пряма розташована так, щоб площі заштрихованих областей дорівнювали одна одній.
дорівнює площі під відповідними діаграмами. Звідси, пряма розташована так, щоб площі заштрихованих областей дорівнювали одна одній.
Висновки, які отримуємо з аналізу рівняння Ван-дер-Ваальса, були підтверджені дослідами Ендрюса, що вивчав ізотермічне стискання вуглекислого газу. Отримані результати з експериментальних (Ендрюс) і теоретичних (Ван-дер-Ваальса) ізотерм відрізняються лише тим, що перетворенню газу в рідину в першому випадку відповідають горизонтальні ділянки, а у другому – хвилеподібні.
Незважаючи на те, що рівняння Ван-дер-Ваальса правильно описує основні явища, пов’язані зі зміною густини газів при зміні тиску p і об’єму V і взаємні переходи рідини і газу, також і важливі відступи від цього рівняння. Це стосується передусім кількісного порівняння теорії з дослідом.
Насамперед, a і b є не зовсім сталі величини, як показують досліди, а вони залежать від температури.
Можна підібрати a і b так, щоб при якійсь температурі T теоретична і дослідна ізотерми зійшлися. Але тоді ізотерми для інших температур не збігатимуться.
При підвищенні температури серед ізотерм з хвилеподібними ділянками є одна, що не має таких ділянок. Така ізотерма називається критичною, а температура  – критичною. При цій температурі зникає різниця між різними станами речовини і коефіцієнт поверхневого натягу дорівнює нулю. Відповідні
– критичною. При цій температурі зникає різниця між різними станами речовини і коефіцієнт поверхневого натягу дорівнює нулю. Відповідні  об’єм
об’єм 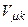 і тиск
і тиск  називаються критичними. Стан з критичними параметрами
називаються критичними. Стан з критичними параметрами 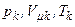 називається критичним станом.
називається критичним станом.
Знайдемо критичні параметри. Якщо
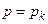 ,
, 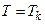 і
і  ,
,
то
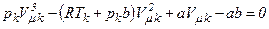 .
.
При 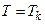 всі три корені збігаються і дорівнюють
всі три корені збігаються і дорівнюють 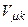 . Отже, рівняння Ван-дер-Ваальса може бути записане у вигляді:
. Отже, рівняння Ван-дер-Ваальса може бути записане у вигляді:
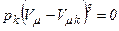 ,
,
або
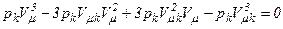 .
.
Отримані вище два вирази рівняння Ван-дер-Ваальса тотожні і в них повинні бути рівні коефіцієнти при однакових степенях. Тому
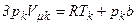 ,
,
 ,
, 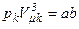 .
.
Поділивши третє рівняння на друге, отримуємо вираз для 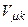 . Якщо підставити отриманий вираз для
. Якщо підставити отриманий вираз для 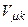 у третє рівняння, маємо вираз для
у третє рівняння, маємо вираз для  . Тоді з першого рівняння, враховуючи вирази для
. Тоді з першого рівняння, враховуючи вирази для  і
і 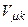 , отримаємо співвідношення для
, отримаємо співвідношення для  . В результаті
. В результаті
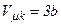 ,
, 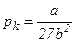 ,
,  .
.
Отже, критичні величини  ,
, 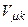 ,
, 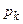 безпосередньо виражаються через Ван-дер-Ваальсівські поправки a і b.
безпосередньо виражаються через Ван-дер-Ваальсівські поправки a і b.
Якщо через крайні точки горизонтальних ділянок сімейства Ван-дер-Ваальсівських ізотерм провести лінії, то одержуємо криву, що обмежує область двофазних станів речовини (рис. 94).
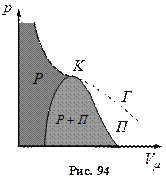
Пара відрізняється від інших газоподібних станів тим, що при ізотермічному стиску відбувається процес зрідження.
Газ, який знаходиться в стані при температурі, що вища за критичну, не може бути перетворений в рідину ні при якому тиску.
Рівняння Ван-дер-Ваальса має той недолік, що воно змінюється від речовини до речовини, оскільки до нього належать параметри a і b, які залежать від природи речовини. Але a і b і R можна виключити, виразивши їх через критичні параметри:
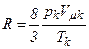 ,
, 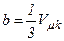 ,
, 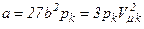 .
.
Тоді рівняння Ван-дер-Ваальса
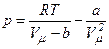
набуває вигляду:
 ,
,
або
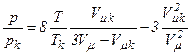 ,
,
Звідси
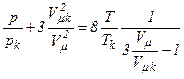 ,
,
або
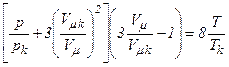 .
.
Введемо зведені параметри, під якими розуміємо відношення змінної величини даного параметра до його критичного значення, а саме:
 – зведена температура,
– зведена температура,
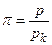 – зведений тиск,
– зведений тиск,
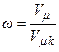 – зведений об’єм.
– зведений об’єм.
В результаті отримуємо зведене рівняння Ван-дер-Ваальса
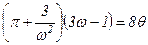 .
.
АВЕНАРІУС МИХАЙЛО ПЕТРОВИЧ
(1835-1895)
Виконав найбільш широкі та систематичні дослідження критичних параметрів цілої низки речовин. Показав, що за критичної температури питомий об’єм рідини не дорівнює питомому об’ємові пари.
Сформулював закон, що відображає залежність між об’ємом, критичною і спостережуваною температурами рідини.
НАДЄЖКІН ОЛЕКСАНДР ІВАНОВИЧ
(1858-1886)
Запропонував у 1885 р. метод визначення критичної температури води за допомогою диференціального денсиметра, який дає змогу встановити критичну температуру непрозорих рідин.

 .
.
 .
.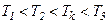 .
.
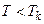 є область станів, де кожному значенню тиску відповідають три точки ізотерми й ізотерма має хвилястоподібну ділянку. При підвищенні температури ці три точки зближуються і при
є область станів, де кожному значенню тиску відповідають три точки ізотерми й ізотерма має хвилястоподібну ділянку. При підвищенні температури ці три точки зближуються і при 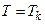 зливаються в одну точку
зливаються в одну точку 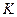 , яка є точкою перегину ізотерми. Дотична до ізотерми в точці
, яка є точкою перегину ізотерми. Дотична до ізотерми в точці 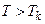 ізотерми Ван-дер-Ваальса близькі до ізотерми ідеального газу.
ізотерми Ван-дер-Ваальса близькі до ізотерми ідеального газу.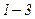 і
і 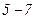 при зменшенні об’єму V зростає тиск p, що відповідає експерименту. Частина ізотерми
при зменшенні об’єму V зростає тиск p, що відповідає експерименту. Частина ізотерми  відповідає газоподібному стану, а частина
відповідає газоподібному стану, а частина 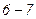 – рідині.
– рідині.
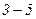 стискання речовини приводить до зменшення тиску p. У природі немає і не може бути таких речовин, в яких із збільшенням тиску p об’єм не зменшується, а зростає. Стан речовини з такими властивостями повинен бути дуже нестійким. Справді, уявимо собі, що такий стан якось реалізовано і нехай в якійсь частині такої речовини з випадкових причин як завгодно мало збільшився тиск. Такі випадкові невеликі зміни не тільки можливі, а й неминучі (флюктуації). Тоді це
стискання речовини приводить до зменшення тиску p. У природі немає і не може бути таких речовин, в яких із збільшенням тиску p об’єм не зменшується, а зростає. Стан речовини з такими властивостями повинен бути дуже нестійким. Справді, уявимо собі, що такий стан якось реалізовано і нехай в якійсь частині такої речовини з випадкових причин як завгодно мало збільшився тиск. Такі випадкові невеликі зміни не тільки можливі, а й неминучі (флюктуації). Тоді це 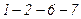 .
.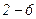 , спостерігається рівновага рідкої і газоподібної фази речовини.
, спостерігається рівновага рідкої і газоподібної фази речовини.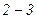 кривої, перебуває в газоподібному стані, тому що частина
кривої, перебуває в газоподібному стані, тому що частина 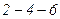 . Стани
. Стани 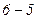 відповідають станам рідини, тому що частина
відповідають станам рідини, тому що частина  . Ці стани речовини називають перегрітою рідиною. Це рідина, яка зберігається при
. Ці стани речовини називають перегрітою рідиною. Це рідина, яка зберігається при  відповідають його знаходженню в газоподібному стані, але він існує у вигляді рідини. Якщо в перегріту рідину кинути піщинку, то відбувається швидкий перехід певної частини рідини із рідкого стану в газоподібний по всьому об’єму, який супроводжується бурхливим кипінням рідини. Тиск газу над рідиною зростає до тиску, що відповідає ділянці
відповідають його знаходженню в газоподібному стані, але він існує у вигляді рідини. Якщо в перегріту рідину кинути піщинку, то відбувається швидкий перехід певної частини рідини із рідкого стану в газоподібний по всьому об’єму, який супроводжується бурхливим кипінням рідини. Тиск газу над рідиною зростає до тиску, що відповідає ділянці  на рис. 92). Стани
на рис. 92). Стани  – метастабільні.
– метастабільні.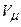 і переходить в область від’ємних тисків. Речовина при від’ємному тиску знаходиться у стані не стиску, а розтягу. Ділянка
і переходить в область від’ємних тисків. Речовина при від’ємному тиску знаходиться у стані не стиску, а розтягу. Ділянка 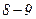 на нижній ізотермі (рис. 92) відповідає перегрітій, а ділянка
на нижній ізотермі (рис. 92) відповідає перегрітій, а ділянка 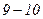 – розтягнутій рідині.
– розтягнутій рідині. З рівняння стану Ван-дер-Ваальса не можна визначити положення горизонтальної частини дослідної кривої відносно максимуму і мінімуму кривої Ван-дер-Ваальса (рис. 93). Це означає, що не можна визначити величину рівноважного тиску насиченої пари при даній температурі. Як показав Максвелл, якщо уявити собі перехід від стану 6 до стану 2, то незалежно від того, як він відбувається, вздовж однофазної кривої
З рівняння стану Ван-дер-Ваальса не можна визначити положення горизонтальної частини дослідної кривої відносно максимуму і мінімуму кривої Ван-дер-Ваальса (рис. 93). Це означає, що не можна визначити величину рівноважного тиску насиченої пари при даній температурі. Як показав Максвелл, якщо уявити собі перехід від стану 6 до стану 2, то незалежно від того, як він відбувається, вздовж однофазної кривої 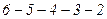 , чи вздовж двофазної прямої
, чи вздовж двофазної прямої  , він повинен супроводжуватися однією і тією ж роботою. Площа під кривою
, він повинен супроводжуватися однією і тією ж роботою. Площа під кривою 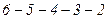 повинна дорівнювати площі під прямою
повинна дорівнювати площі під прямою 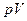 дорівнює площі під відповідними діаграмами. Звідси, пряма розташована так, щоб площі заштрихованих областей дорівнювали одна одній.
дорівнює площі під відповідними діаграмами. Звідси, пряма розташована так, щоб площі заштрихованих областей дорівнювали одна одній. – критичною. При цій температурі зникає різниця між різними станами речовини і коефіцієнт поверхневого натягу дорівнює нулю. Відповідні
– критичною. При цій температурі зникає різниця між різними станами речовини і коефіцієнт поверхневого натягу дорівнює нулю. Відповідні 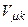 і тиск
і тиск  називаються критичними. Стан з критичними параметрами
називаються критичними. Стан з критичними параметрами 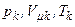 називається критичним станом.
називається критичним станом.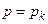 ,
,  ,
,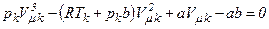 .
.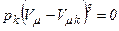 ,
,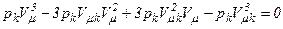 .
.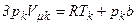 ,
,  ,
, 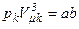 .
.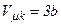 ,
, 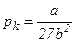 ,
,  .
.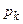 безпосередньо виражаються через Ван-дер-Ваальсівські поправки a і b.
безпосередньо виражаються через Ван-дер-Ваальсівські поправки a і b.
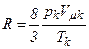 ,
, 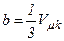 ,
, 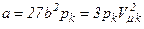 .
.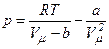
 ,
,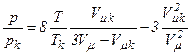 ,
,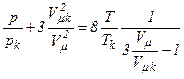 ,
,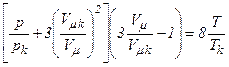 .
. – зведена температура,
– зведена температура,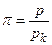 – зведений тиск,
– зведений тиск,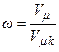 – зведений об’єм.
– зведений об’єм.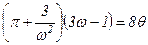 .
.


