Врахування притягання молекул
Дія сил притягання між молекулами реального газу приводить до появи додаткового тиску на газ, що називається внутрішнім тиском. Для обчислення значення поправки
Сила f, що діє в бік стінки на одну молекулу, що знаходиться перед стінкою, пропорційна до тиску n молекул в одиниці об’єму, що знаходиться за стінкою:
Увесь додатковий тиск
Оскільки
Рівняння стану реальних газів можна отримати, якщо в рівняння Клапейрона-Менделєєва ввести поправки, які зв’язані з врахуванням власного об’єму молекул і сил притягання молекул. Тоді рівняння стану набере вигляду:
Це рівняння має назву рівняння Ван-дер-Ваальса:
Для довільної маси m газу
a і b – сталі для кожного газу величини, що визначаються дослідно (записуються рівняння Ван-дер-Ваальса для двох відомих з досліду станів газу і розв’язуються відносно a і b). Виводячи рівняння Ван-дер-Ваальса, було допущено ряд спрощень, тому воно досить наближене. При малих тисках p і високих температурах T об’єм
|

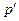 розглянемо молярний об’єм газу
розглянемо молярний об’єм газу  (рис. 90), в якому подумки виділимо площину – стінку, по обидві сторони якої знаходиться газ.
(рис. 90), в якому подумки виділимо площину – стінку, по обидві сторони якої знаходиться газ.
 .
. .
. , то
, то  .
. .
. .
. .
. ,
, 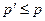 і рівняння Ван-дер-Ваальса в даному випадку збігається з рівнянням Клапейрона-Менделєєва.
і рівняння Ван-дер-Ваальса в даному випадку збігається з рівнянням Клапейрона-Менделєєва.


