Внутренняя энергия газа
Выражение для внутренней энергии идеального газа
(30. 1) было получено без учета взаимодействия молекул. Для реального газа в выражении (30. 1) необходимо прибавить потенциальную энергию
(30. 2) Потенциальная энергия
(30. 3)
где
(30. 4)
Так как эта работа идет на приращение потенциальной энергии взаимодействия молекул
Сравнивая соотношение (30. 4) и (30. 5), получаем выражение для потенциальной энергии взаимодействия молекул:
(30. 6) Подставляя формулу (30. 6) в соотношение (30. 2), получаем выражение для внутренней энергии газа:
(30. 7) ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ 2 1. Уравнение состояния идеального газа
2. Внутренняя энергия идеального газа
3. Распределение Максвелла
4. Барометрическая формула
5. Распределение Больцмана
6. Явление переноса
7. Первый закон термодинамики
8. Теплоемкость идеального газа при постоянном объеме
9. Теплоемкость идеального газа при постоянном давлении
10. Адиабатический процесс
11. Энпропия
12. Второй и третий законы термодинамики
13. Силы межмолекулярного взаимодействия в реальных газах
14. Уравнение Ван - дер - Вальса
15. Внутренняя энергия реального газа
|


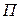 взаимодействия молекул газа:
взаимодействия молекул газа:
 до
до  газ совершает работу против сил взаимного притяжения молекул
газ совершает работу против сил взаимного притяжения молекул
 - дополнительное давление, испытываемое газом вследствие сил межмолекулярного притяжения. Подставляя формулу (29. 3) в выражениях (30. 3) и интегрируя, имеем
- дополнительное давление, испытываемое газом вследствие сил межмолекулярного притяжения. Подставляя формулу (29. 3) в выражениях (30. 3) и интегрируя, имеем
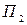 -
- 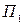 , можем написать
, можем написать (30. 5)
(30. 5)




