Главное в главе 3
Методами теории вероятностей исследованы количественные характеристики (распределения) молекул. Все распределения молекул являются следствиями принципа Больцмана: принцип Больцмана описывает распределения молекул (или частиц), обладающих определенной энергией. Если W — энергия молекул газа, то их концентрация в этой точке равна
Там, где концентрация частиц равна п 0, энергия принята равной W = 0. В формуле Т — абсолютная температура газа, k = 1,38 ⋅ 10–23 Дж/К — постоянная Больцмана. Частными случаями принципа Больцмана являются распределение Максвелла и барометрическая формула. Распределение Максвелла (рис. 3.26): доля, вероятность, что молекулы имеют скорость, лежащую в интервале от V до V + dV, равна dN / N = F (V) dV = F (u), и тогда
где безразмерная относительная скорость и = V / V нвсвязана с наиболее вероятной скоростью V нв:
Рис. 3.26. Распределение Максвелла. Полная вероятность (площадь S под графиком равна единице) Барометрическая формула (рис. 3.27): распределение концентрации молекул и давления в атмосфере:
где характерная длина изменения
Рис. 3.27. Барометрическая формула Рассмотрены также термоэлектрический эффект и теория термопары. Термопара рекомендована в Фармакопее, как прибор для измерения температуры. Измерение температуры при этом заменяется измерением контактной ЭДС ε = ε0 + α(T – T 0), (3.56) где α — термоэлектрическая постоянная, характеристика металлов, находящихся в контакте.
|

 (3.20)
(3.20) (3.42)
(3.42)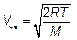 (3.37)
(3.37)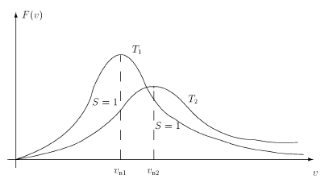
 (3.46)
(3.46) (3.47)
(3.47)



