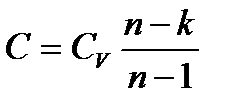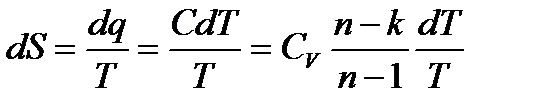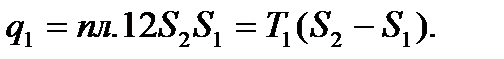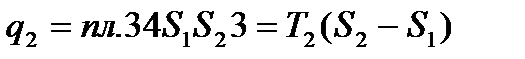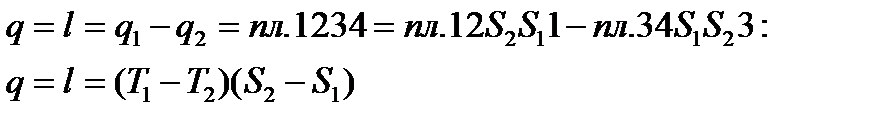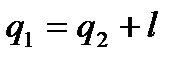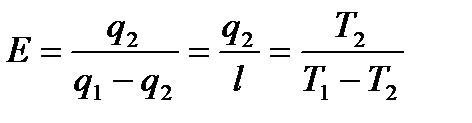Газовые процессы в TS− диаграмме.
1. Изотермический процесс. При изотермическом процессе T=const. Поэтому TS − диаграмме он изображается прямой линией, параллельной оси абсцисс.
С учетом того, что dT=0, зависимости изменения энтропии идеального газа в изотермическом процессе примут вид
(уходит слагаемое
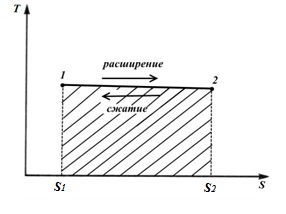
Процесс 1-2 – это процесс, в котором энтропия увеличивается, а следовательно, к газу подводится теплота и газ совершает работу расширения, эквивалентную этой теплоте. Процесс2-1− это процесс сжатия, в котором теплота, эквивалентная работе сжатия, отводится от газа и энтропия уменьшается Площадь фигуры S1 12 S2 соответствует количеству теплоты q, сообщаемому газу, и одновременно работе l (изотермический процесс) 2. Адиабатный процесс В адиабатном процессе q=0 и dq=0, а следовательно dS=0.
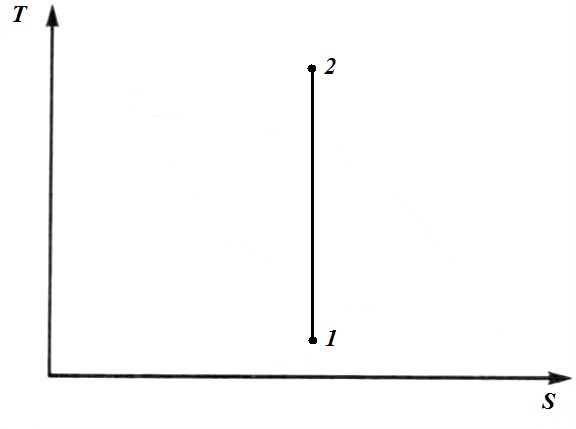
Следовательно, в адиабатном процессе S=const и в TS − диаграмме адиабатный процесс изображается прямой линией, параллельной оси T. Поскольку в адиабатном процессе S=const,то адиабатные обратимые процессы называют также изоэнтропными. При адиабатном сжатии температура рабочего тела повышается, а при расширении понижается. Поэтому процесс1-2 – это процесс сжатия, а процесс 2-1 – это расширение.
Из уравнения
При k=const получим
или
Для обратимого адиабатного процесса S1=S2=const, тогда из (*)
Откуда,
− уравнение адиабаты в координатах p и V. 3. Изохорный процесс Для изохорного процесса V=const, dV=0. При постоянной теплоемкости (из ур. (1))
Подкасательная к кривой процесса в любой её точке определяет значение истинной теплоёмкости CV. Подкасательная будет положительной только в том случае, если кривая будет обращена выпуклостью вниз. Площадь под кривой процесса 1-2 на TS – диаграмме дает в масштабе количество подведенной (или отведенной в процессе 2-1) теплоты q, равное изменению внутренней энергии U2-U1.
4. Изобарный процесс В изобарном процессе давление постоянное p=const В этом случае
Следовательно, при p=const как и при V=const изобара является логарифмической кривой, поднимается следа направо и обращена выпуклостью вниз.
Подкасательная к кривой 1-2 в любой её точке дает значения истинной теплоёмкости Cp. Площадь под кривой дает кол-во теплоты q, которая сообщается газу при p=const, равное изменению энтальпии i2-i1. 5. Политропный процесс В политропном процессе
Тогда,
Отсюда, для конечного изменения состояния газа
Политропный процесс на TS – диаграмме изображается кривой, расположение которой зависит от показателя n. 6. Круговой процесс. Цикл Карно. Изобразим в TS – диаграмме произвольный обратимый цикл 1a2b1.
В процессе 1a2 рабочее тело получает кол-во теплоты q1, численно равное площади под кривой 1a2, а в процессе 2- b -1 отдает кол-во теплоты q2, численно равное площади под кривой 2- b -1. Часть теплоты
переходит в работу цикла l (∆u=0 в цикле). Работа цикла положительна, если цикл проходит по часовой стрелке и отрицательна, если против часовой стрелки (направление цикла в pV и TS − диаграммах одинакова). Термический к.п.д. кругового процесса
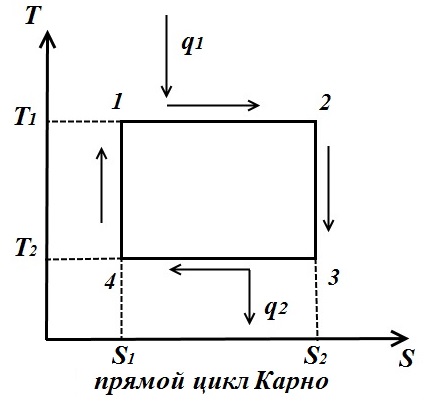
Изменение энтропии в любом цикле равно нулю. Цикл Карно состоит из двух изотерм и двух адиабат. В TS – диаграмме он будет изображаться в виде прямоугольника (горизонтальные линии – изотермы, вертикальные – адиабаты)
Количество теплоты, подведенное к рабочему телу, числено равно площади прямоугольника 12 S2S1:
Количество теплоты, отведенное к холодильнику, соответствует площади прямоугольника 34 S1S2:
Теплота, эквивалентная работе цикла, равная площади цикла
Термический к.п.д. цикла
Для обратного цикла (рис. справа)
Холодильный коэффициент обратного цикла
|

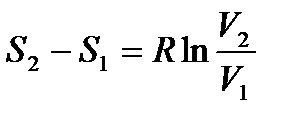 (1)
(1) в правой части)
в правой части)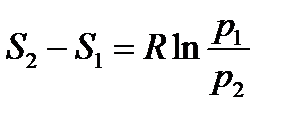 (2)
(2)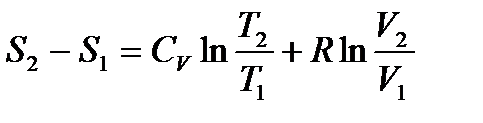 через T,V (1)
через T,V (1)
 Tp (2)
Tp (2)
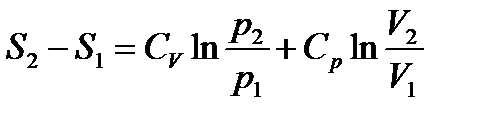 pV (3)
pV (3)

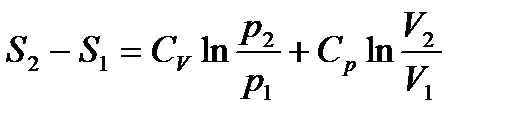 (3)
(3)
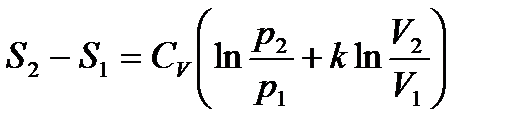
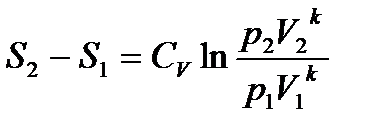 (*)
(*)
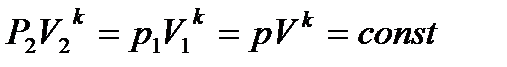
 − вид на TS – диаграмме
− вид на TS – диаграмме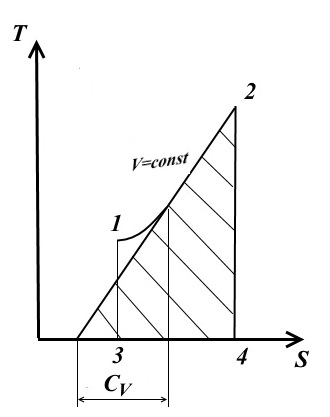
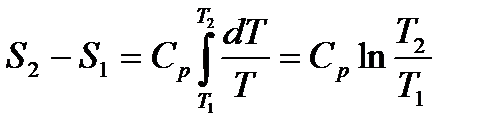 из (2)
из (2)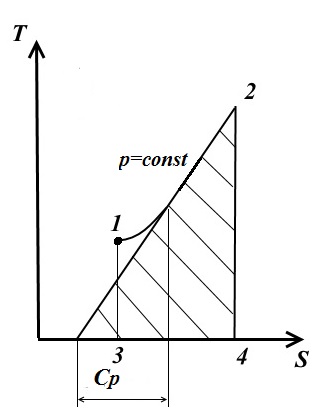
 .Теплоёмкость в этом процессе
.Теплоёмкость в этом процессе