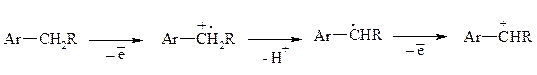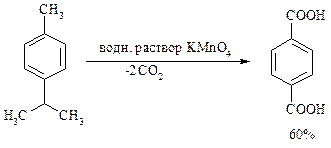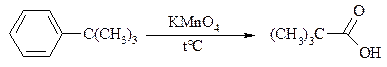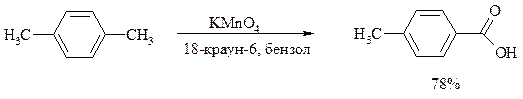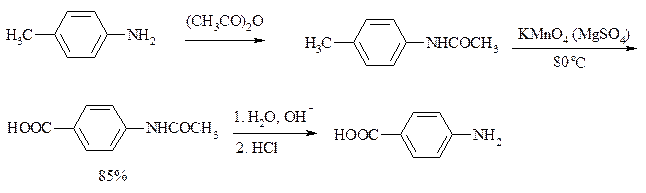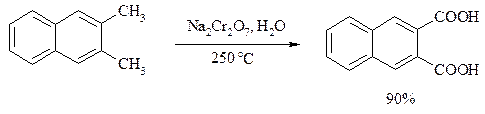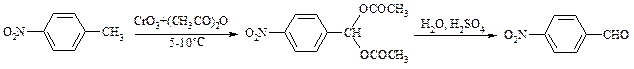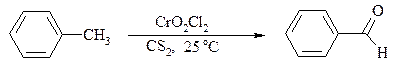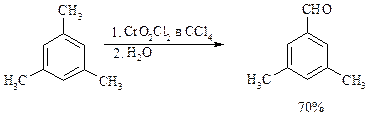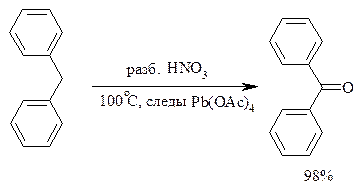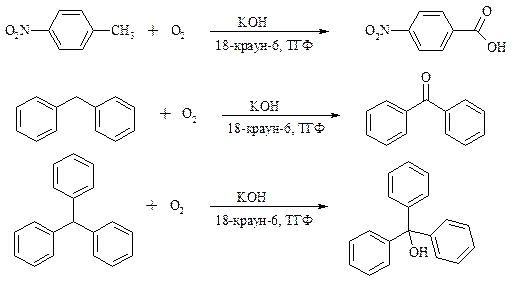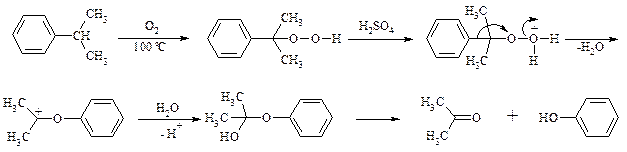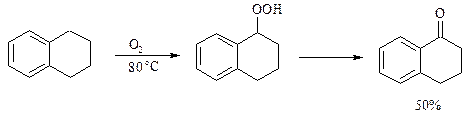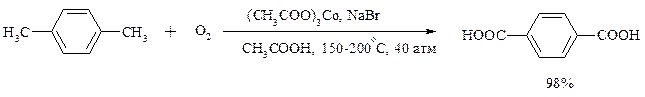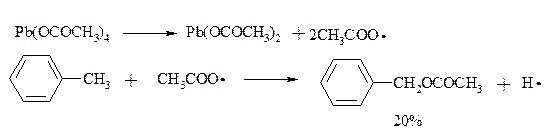В АРОМАТИЧЕСКИХ СОЕДИНЕНИЯХ
Окисление алкиларенов происходит в первую очередь по бензильному атому углерода, что объясняется легкостью образования соответствующего бензильного радикала.
Для окисления боковых цепей в алкилбензолах в карбоксильную группу применяют водный раствор KMnO4 при нагревании, смесь Na2Cr2O7 и H2SO4.
Следует особо отметить, что в этих условиях любая алкильная группа, содержащая атомы водорода в a-положении по отношению к бензольному кольцу, окисляется до карбоксильной. Если алкильная группа не содержит атомов водорода в a-положении по отношению к бензольному кольцу, такая трет -алкильная боковая группа не окисляется под действием Na2Cr2O7 или KMnO4 в кислой или нейтральной среде. Так, например, трет -бутилбензол окисляется в очень жестких условиях перманганатом калия до триметилуксусной кислоты, т. е. окисляется само бензольное кольцо:
Однако водная азотная кислота окисляет трет -алкильные группы до карбоксильных. Дихромат натрия и перманганат калия нерастворимы в ароматических углеводородах, поэтому окисление идет в гетерогенных условиях, что часто резко снижает выход продуктов окисления. Этого недостатка лишен метод межфазного переноса реагентов. Твердый перманганат калия частично растворяется в бензоле в присутствии 18-краун-6-полиэфира вплоть до концентрации 0.06 М. Такой раствор носит название "пурпурный (малиновый) бензол" и широко используется для окисления алкилбензолов:
При использовании же в качестве катализатора межфазного переноса бромида тетрабутиламмония практически весь (95%) перманганат-ион находится в органической фазе. При синтезе аминобензойных кислот из алкиланилинов, содержащих первичную аминогруппу, используют ацильную защиту:
Алкильную группу в алкилнафталинах можно окислить до карбоксильной, не затронув при этом нафталиновые ядра, если использовать в качестве окислителя нейтральный водный раствор дихромата натрия и проводить реакцию при высоких температурах в автоклаве:
Для окисления метилбензолов в альдегиды используют смесь хромового и уксусного ангидридов. При этом образующийся альдегид превращается в ацилаль, который далее не окисляется. Омылением этого производного серной кислотой получают сам альдегид. Орто -замещенные бензальдегиды получаются таким путем с низкими выходами.
Другой способ превращения метилзамещенных бензолов в бензальдегиды состоит в их обработке хлористым хромилом в CCl4 или CS2 (реакция Этара). Вначале окисляемое вещество образует комплекс с двумя молекулами CrO2Cl2, который выпадает в осадок. При обработке комплекса водой образуется альдегид.
Данный метод дает возможность окислять только одну метильную группу в присутствии других:
Окисление метиленового звена в алкилбензолах с образованием кетонов можно провести под действием ряда окислителей (разб. HNO3, SeO2, Na2Cr2O7 и др.). Особенно легко окисляются диарилметаны:
Окисление жирноароматических соединений можно осуществлять таким образом, чтобы окислению кислородом воздуха подвергался карбанион, который образуется при депротонировании исходной СН-кислоты в инертной апротонной среде (ТГФ, диметоксиэтане). Жирноароматических соединений с p Ka ниже 33-35 можно окислить в системе КОН - 18-краун-6 - ТГФ до ароматических кислот, кетонов и триарилкарбинолов:
Окисление кумола в гидропероксид с последующим разложением его серной кислотой приводит к образованию ацетона и фенола:
Аналогично из индана и тетралина можно получить соответствующие кетоны:
Важнейшее промышленное значение имеют реакции прямого окисления о - и n- ксилолов кислородом воздуха до фталевой и терефталевой кислот соответственно в присутствии ацетата кобальта (III) в уксуснокислом растворе:
Введение ацетоксигруппы в бензильное положение алкилбензолов обычно осуществляют с помощью тетраацетата свинца. Реакцию проводят кипячением смеси реагентов в бензоле или ледяной уксусной кислоте. Процесс протекает по свободнорадикальному механизму:
Соответствующие спирты получают последующим омылением ацетатов.
|