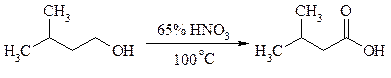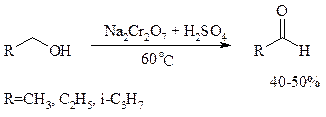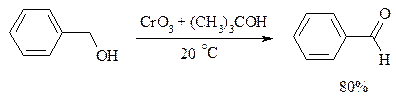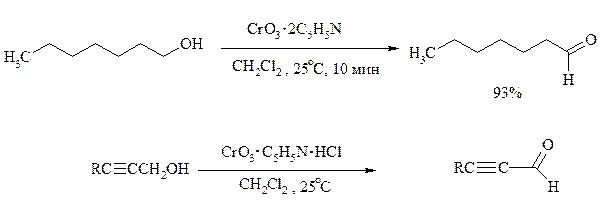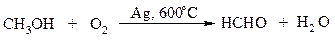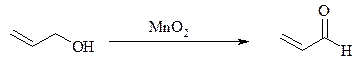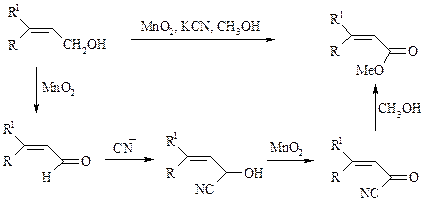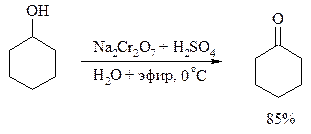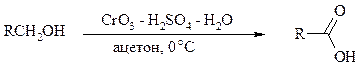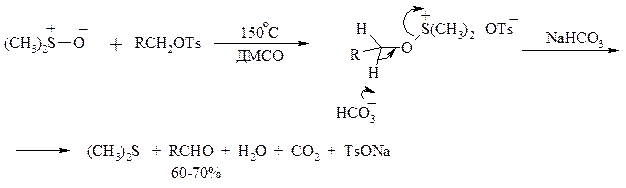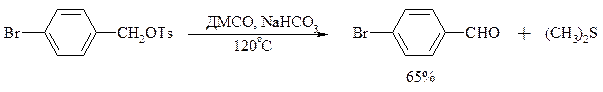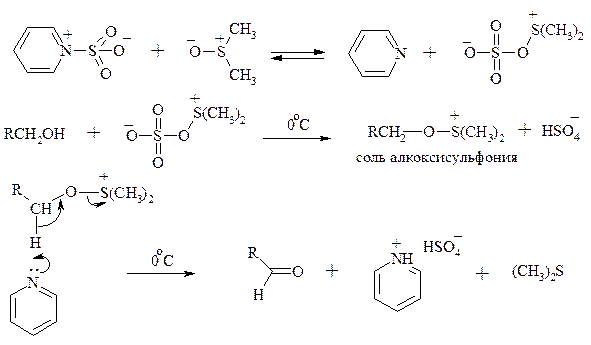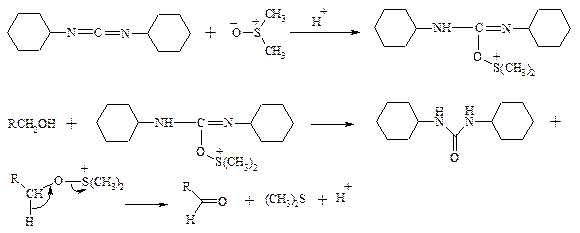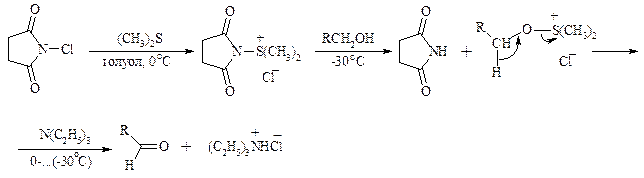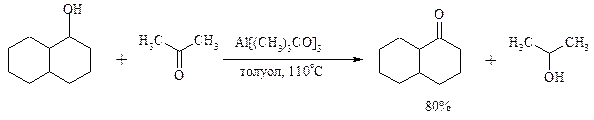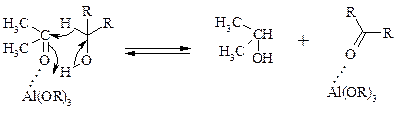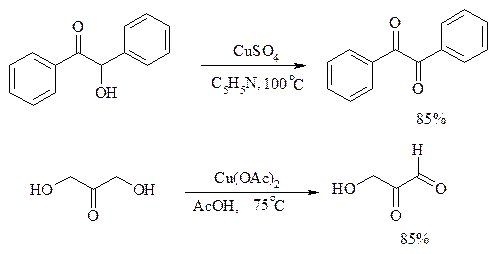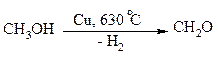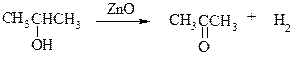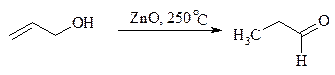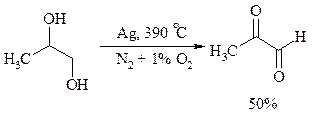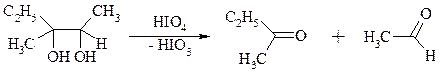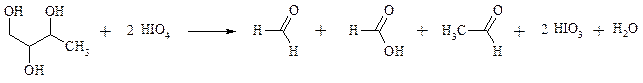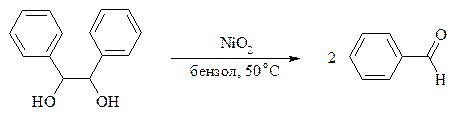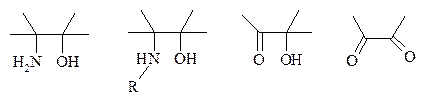ОКИСЛЕНИЕ ОДНОАТОМНЫХ СПИРТОВ
Под действием концентрированной HNO3, щелочного раствора KMnO4 и многих других окислителей первичные спирты окисляются в карбоновые кислоты:
При окислении первичных спиртов до альдегидов дихроматом натрия и серной кислотой образующийся альдегид, кипящий, как правило, при температуре значительно ниже, чем исходный спирт, немедленно удаляют отгонкой и тем предотвращают его дальнейшее окисление. Таким путем могут быть получены только низкокипящие альдегиды.
Для получения высококипящих альдегидов в качестве окислителя применяют трет -бутиловый эфир хромовой кислоты (получается из CrO3 и трет -бутанола):
Для селективного окисления первичных спиртов до альдегидов в настоящее время лучшими реагентами являются комплекс CrO3 с двумя молями пиридина: CrO3·2С5Н5N (реагент Саррета - Коллинза) и хлорхромат пиридиния CrO3·С5Н5N·HCl (реагент Кори) в хлористом метилене. Оба реагента обеспечивают очень высокие выходы альдегидов, однако хлорхромат пиридиния имеет важное преимущество в том отношении, что этот реагент не затрагивает двойную или тройную связь и поэтому особенно эффективен для получения ненасыщенных альдегидов:
Один из промышленных способов получения формальдегида заключается в окислении метанола кислородом воздуха на серебряном катализаторе:
Аллиловые, бензиловые и пропаргиловые спирты можно окислять до альдегидов диоксидом марганца:
Этот реагент окисляет в петролейном эфире или хлористом метилене ненасыщенные спирты с одной или несколькими двойными или тройными связями без изомеризации и перегруппировки. Однако, если окисление диоксидом марганца проводить в присутствии цианид-иона, то аллиловые спирты окисляются до карбоновых кислот или их сложных эфиров (в последнем случае спирты используются в качестве растворителей). В этом варианте окисления первоначально также образуется альдегид, но в присутствии цианид-иона он дает циангидрин, который содержит группировку аллилового спирта и поэтому способен окисляться далее под действием того же окислителя.
С высоким выходом бензиловый спирт может быть превращен в бензальдегид под действием 1-хлор- или 1-бромбензотриазола. Для превращения вторичных спиртов в кетоны используют смесь дихромата натрия и серной кислоты.
Если в молекуле спирта содержится кратная углерод-углеродная связь, то окисление ведут при комнатной или пониженной температурах в инертных неполярных растворителях строго рассчитанным количеством CrO3 в водной серной кислоте (реагент Джонса). Первичные спирты окисляются реагентом Джонса до карбоновых кислот:
В последнее время разработан целый ряд новых эффективных методов окисления первичных и вторичных спиртов с помощью ДМСО или комплексов ДМСО с различными электрофильными агентами. Тозилаты первичных спиртов, также как и бензилтозилаты, окисляются в альдегиды при нагревании в ДМСО в течение 10-30 мин при 120-150°С в присутствии гидрокарбоната натрия как слабого основания:
ДМСО в этой реакции выполняет роль нуклеофильного агента, который замещает тозилоксигруппу по S N 2 механизму с образованием алкоксисульфониевых солей. Катион алкоксисульфония далее подвергается окислительно-восстановительному элиминированию, при этом гидрокарбонат или карбонат-ион является основанием в этой Е2-реакции элиминирования, приводящей к альдегиду и диметилсульфиду.
Однако данный метод окисления первичных спиртов в альдегиды требует проведения дополнительной стадии превращения спирта в тозилат. Одностадийное селективное окисление достигается путем превращения слабого нуклеофильного агента ДМСО в сильный электрофильный агент, который непосредственно реагирует с первичными и вторичными спиртами в очень мягких условиях при 0°С и ниже. Необходимую активацию ДМСО проводят с помощью триоксида серы, трифторуксусного ангидрида, уксусного ангидрида, N-хлорсукцинимида, N,N-дициклогексилкарбодиимида С6Н11N=C=NC6H11, бромоводорода, оксалилхлорида (COCl)2, хлористого тионила SOCl2 и др. Во всех случаях в качестве реакционноспособного интермедиата образуется активированная алкоксисульфониевая соль, которая далее подвергается внутримолекулярной окислительно-восстановительной фрагментации. Комплекс ДМСО с SО3 образуется при взаимодействии пиридинсульфотриоксида с ДМСО:
Наиболее часто используется комбинация ДМСО с N,N-дициклогексилкарбодиимидом (метод Пфитцера - Моффата):
Диметилсульфид при взаимодействии с N-хлорсукцинимидом дает хлорсульфониевую соль, которая реагирует со спиртами уже при -30°С с образованием карбонильного соединения:
Вторичные спирты можно превратить в кетоны под действием кетонов (обычно ацетона) и алкоголятов алюминия (реакция Оппенауэра). Если в систему вводить большой избыток ацетона (50-200 молей), то равновесие сдвигается в сторону образования кетона из вторичного спирта. После установления равновесия реакционную смесь обрабатывают 30%-ной серной кислотой, отгоняют избыток ацетона и образовавшийся изопропанол и выделяют продукт окисления – кетон. В качестве акцептора водорода вместо ацетона иногда берут циклогексанон (избыток до 20 молей). Катализаторами служат трет -бутилат алюминия или изопропилат алюминия (не менее 0.25 моля на 1 моль окисляемого соединения; лучше 1-3 моля на 1 моль). Реакцию проводят в кипящем бензоле или толуоле.
Роль алкоголята алюминия сводится к тому, что он образует комплекс с ацетоном и, действуя как кислота Льюиса, увеличивает избыточный положительный заряд на карбонильном атоме углерода. Благодаря этому в реакционном комплексе, включающем окисляемый спирт, облегчается гидридный переход от атома углерода, связанного с гидроксильной группой, что в конечном счете и приводит к превращению исходного спирта в кетон.
Окисление a-гидроксикетонов (ацилоинов) в соответствующие дикарбонильные соединения легко осуществляется при действии солей меди (II):
Третичные спирты весьма устойчивы к окислению и в жестких условиях происходит окисление с разрывом углерод-углеродных связей и образование кислот и (или) кетонов, содержащих меньше углеродных атомов, чем исходный спирт. Обычно окисление проводят в кислой среде. При этом спирт сначала дегидратируется до алкена, который далее легко расщепляется:
Дегидрирование спиртов. Окисление первичных и вторичных спиртов в карбонильные соединения сводится по существу к отщеплению водорода от молекулы исходного спирта. Такое отщепление можно осуществить не только с помощью окислителей, но и используя каталитическое дегидрирование. В качестве катализаторов обычно применяют тонкодисперсные медь и серебро, а также оксид цинка, которые для придания им структурной устойчивости наносят в тонкодисперсном состоянии на пемзу, асбест или другие инертные носители.
При дегидрировании изопропанола над медно-цинковым катализатором при 450ºС или оксидом цинка при 380ºС образуется ацетон:
В случае высококипящих спиртов реакцию проводят при пониженном давлении. Непредельные спирты в обычных условиях дегидрирования превращаются в соответствующие предельные карбонильные соединения. Гидрирование кратной связи осуществляется выделяющимся в процессе дегидрирования водородом.
Простейшие двухатомные спирты при каталитическом дегидрировании образуют дикарбонильные соединения:
8. РАСЩЕПЛЕНИЕ α-ГЛИКОЛЕЙ И РОДСТВЕННЫХ СОЕДИНЕНИЙ
Под действием иодной кислоты HIO4 и ее солей, а также тетраацетата свинца Pb(OAc)4 1,2-диолы и полиолы подвергаются окислительному расщеплению с образованием альдегидов и кетонов:
Если в исходном полиоле три или более гидроксильных групп связаны с соседними атомами углерода, то из средних атомов углерода образуются карбоновые кислоты.
При использовании тетраацетата свинца вторичные спиртовые группы в полиолах окисляются до диоксида углерода. Для окисления 1,2-диолов, растворимых в воде или в бинарной смеси вода – ТГФ, вода – диоксан, используют HIO4 и ее соли, для окисления нерастворимых в воде диолов – тетраацетат свинца в бензоле или в уксусной кислоте. В обоих вариантах окислительной деструкции 1,2-диолов в качестве интермедиата образуются циклические эфиры иодной или свинцовой кислоты. Циклические эфиры затем подвергаются окислительно-восстановительному элиминированию с образованием карбонильных соединений и иодат-иона или ацетата свинца (II) соответственно:
Для окислительного расщепления 1,2-диолов используются и другие реагенты: соли церия (IV), ванадия (V), фенилиодозодиацетат С6H5I(OCOCH3)2, хлорохромат пиридиния и др. В некоторых случаях для окисления диолов в нейтральной среде применяют пероксид никеля NiO2 и MnO2:
Такие окислители как KMnO4, Na2Cr2O7, N-иодсукцинимид также расщепляют 1,2-гликоли, но при этом вместо альдегидов образуются карбоновые кислоты. Аналогичное расщепление наблюдается и для других соединений, содержащих атомы кислорода или азота у соседних атомов углерода: b-аминоспирты, a-гидроксиальдегиды и a-гидроксикетоны, a-дикетоны, a-кетоальдегиды, глиоксаль.
a-Дикетоны и a-гидроксикетоны расщепляются также под действием H2O2 в щелочной среде.
|