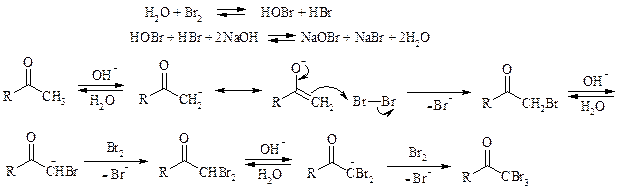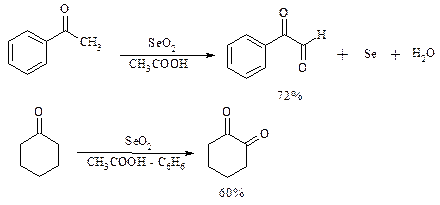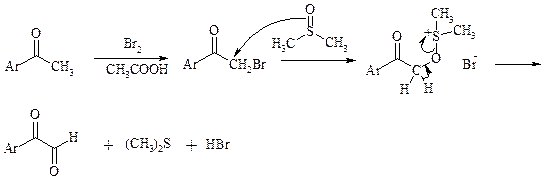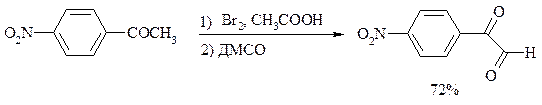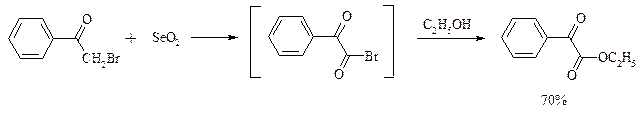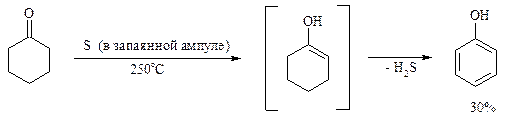ОКИСЛЕНИЕ КЕТОНОВ
Окисление кетонов протекает в более жестких условиях, чем окисление альдегидов и сопровождается расщеплением углеродного скелета молекулы. Из несимметрично построенного кетона при окислении могут образоваться все четыре возможные карбоновые кислоты (правило Попова):
Если кетон в a-положении содержит третичный атом углерода, то в результате окисления образуется три карбоновые кислоты и новый кетон, который в зависимости от условий может или подвергнуться дальнейшему окислению, или остаться неизменным:
Кетоны, как правило, устойчивы к окислению в нейтральной среде и подвергаются расщеплению только в кислой и щелочной средах: щелочным раствором KMnO4, горячей HNO3, соединениями Cr(VI) в серной кислоте. В связи с этим считают, что окислению кетона предшествует его енолизация; образовавшийся енол подобно другим алкенам окисляется по кратной связи с расщеплением углеродного скелета. Поскольку несимметричные кетоны могут енолизоваться в обоих возможных направлениях, их окислительное расщепление также осуществляется по двум направлениям. Промышленное значение имеет окисление циклогексанона, поскольку он легко доступен и при расщеплении дает только одну адипиновую кислоту. Реакцию проводят при повышенной температуре, применяя в качестве окислителя конц. HNO3, CrO3+H2SO4, щелочной раствор KMnO4:
При окислении азотной кислотой алициклических кетонов температура реакции может быть снижена, а выход продукта повышен, если применять более разбавленную азотную кислоту и добавлять в реакционную смесь каталитические количества V2O5. Циклические 1,3-дикетоны, которые существуют в основном в моноенольной форме, расщепляются периодатом натрия NaIO4 с потерей одного атома углерода:
Метилкетоны легко превращаются в соответствующие карбоновые кислоты при обработке их щелочными растворами гипобромита или гипохлорита натрия, т. е. смесью галогена и щелочи (галоформная реакция). Таким образом из окиси мезитила можно, например, получить b,b-диметилакриловую кислоту:
Метиларилкетоны окисляются с еще более высокими выходами. Реакция обычно проводится в водно-диоксановом растворе:
Механизм процесса можно представить следующим образом:
Далее под действием щелочи тригалогенметилкетон расщепляется по следующей схеме:
Под действием перкислот, а также кислоты Каро H2SO5 и H2S2O8 кетоны окисляются в сложные эфиры (реакция Байера-Виллигера). Реакция обычно проводится при комнатной температуре в полярных органических растворителях, устойчивых к действию надкислот (хлороформ, уксусная кислота, уксусный ангидрид):
Наилучшие результаты достигаются при расщеплении алифатических и циклических кетонов комплексом 90%-ного пероксида водорода и эфирата трехфтористого бора:
В начале под действием надкислоты, если она достаточно сильная, или каталитических количеств серной кислоты происходит протонизация карбонильного атома кислорода кетона. При этом карбонильный атом углерода приобретает избыточный положительный заряд. Затем к нему нуклеофильно присоединяется анион надкислоты. Последующий гетеролитический разрыв связи кислород-кислород, миграция одного из радикалов в виде аниона к положительно заряженному атому кислорода и отрыв протона приводят к образованию сложного эфира:
Несимметричные кетоны в общем случае образуют два изомерных сложных эфира, соотношение которых зависит от относительной способности групп к миграции к атому кислорода. По способности к миграции группы располагаются в следующем ряду H > C6H5 > (CH3)3C >> (CH3)2CH > RCH2 >> CH3. Если две группы сильно различаются по способности к миграции, реакция характеризуется высокой региоселективностью. Особое значение имеет реакция Байера-Виллигера для циклических кетонов, которые при окислении дают циклические сложные эфиры – лактоны:
Метиленовая (метильная) группа в a-положении к карбонильной группе кетонов легко окисляется диоксидом селена:
Для реакции окисления кетонов, а также альдегидов диоксидом селена был предложен следующий механизм:
Вместо прямого окисления можно воспользоваться двухстадийным методом, приведенным ниже:
Алкоксисульфониевая соль, образующаяся при замещении галогена или тозилата, подвергается внутримолекулярному окислению-восстановлению с образованием кетоальдегида:
В то же время окисление α-бромкетонов диоксидом селена в спиртовой среде приводит к α-кетоэфирам:
Под действием раствора полисульфида аммония (как правило, под давлением) арилалкилкетоны превращаются в ω-арилкарбоновые кислоты с сохранением общего числа атомов углерода (реакция Вильгеродта):
В результате карбонильная группа кетона восстанавливается до метиленовой, а метильная окисляется до карбоксильной. Фактически сначала получают тиоамид (или амид) кислоты, который затем омыляют. С ростом числа атомов углерода в цепи (n) выходы карбоновых кислот падают. Улучшенный вариант реакции, не требующий применения давления, заключается в применении вместо полисульфида серы и вторичного амина (обычно морфолина) (модификация Киндлера):
При обработке циклогексанонов серой или селеном протекает дегидрирование и образуются фенолы. По-видимому, реакция протекает через стадию предварительной енолизации исходных кетонов:
|