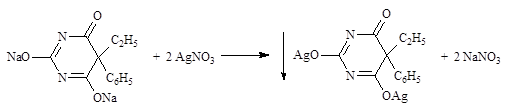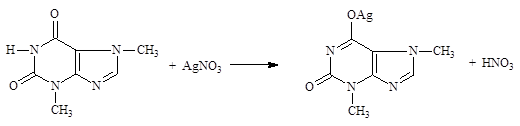Лекарственные вещества, содержащие лактамную группу
Лактамная группа образуется из аминокислот. Лактамы являются внутримолекулярными (циклическими) амидами
Лекарственные вещества, содержащие лактамную группу: антибиотики группы b -лактамидов (бензилпенициллина натриевая, калиевая, новокаиновая соли, феноксиметилпенициллин, оксациллина натриевая соль, ампициллин, цефалексин, цефалотин). К о л и ч е с т в е н н о е о п р е д е л е н и е по лактамной группе не проводят. При необходимости используют метод Кьельдаля. Фотоколориметрический (ФЭК) и спектрофотометрический (СФ) метод на основе гидроксамовой реакции.
10. Имидная группа входит в структуру производных
11. Сульфамидная группа входит в структуру бензосуль-
фониламидов и их производных: сульфаниламидов (стрептоцид, сульфацил-натрий, фталазол), производных амида хлорбензолсульфоновой кислоты (фуросемид, дихлотиазид), замещенных сульфонилмочевины (глибенкламид). Лекарственные вещества, содержащие имидную группу, обладают слабыми кислотными свойствами, т.к. электронная плотность с атома азота смещена к атомам кислорода карбонильных групп, вследствие чего водород при нем приобретает подвижность. Для соединений, содержащих имидную группу, характерна имидно-имидольная таутометрия.
В анализе лекарственных веществ, содержащих имидную и сульфамидную функциональные группы, используются реакции, в основе которых лежат их кислотные свойства.
барбитал Э = М.м.
При анализе соединений, обладающих очень слабыми кислотными свойствами (Кд < 10–8), определение проводят в среде протофильного растворителя – диметилформамида (ДМФА). Метод применяется в фармакопейном анализе (барбитал, фенобарбитал, бензонал, фталазол, метилурацил, фторурацил).
Э= М.м.
фторурацил Э= М.м.
Ацидиметрический метод (вариант вытеснения, способ прямого титрования). Основан на вытеснении слабых органических кислот из их солей титрантом – сильной минеральной кислотой) применяют для солевых форм соединений с имидной и сульфамидной группами. Метод используется в количественном определении солевых форм препаратов в фармакопейном анализе (барбитал-натрий, гексобарбитал-натрий) и во внутриаптечном контроле (сульфацил-натрий, барбитал-натрий, этаминал-натрий).
Э = М.м.
сульфацил-натрий Э = М.м. Аргентометрический метод. Способ прямого титрования. Определение может быть проведено в следующих вариантах:
Э = М.м.
2. Титрование по методу Мора. При определении в присутствии индикатора калия хромата (среда слабощелочная) сначала осаждается двузамещенная серебряная соль, затем избыточная капля титранта реагирует с индикатором, образуя осадок кирпично-красного цвета.
2AgNO3 + K2CrO4 ® ¯Ag2CrO4 + 2KNO3
При титровании по Мору производных барбитуровой кислоты, имеющих заместители при азоте в положении 3 определение идет следующим образом: сначала образуется моносеребряная соль, а затем избыточная капля титранта реагирует с индикатором:
2AgNO3 + K2CrO4 ® ¯Ag2CrO4 + 2KNO3 Э = М.м. Алкалиметрический метод (вариант нейтрализации, способ косвенного определения). Основан на свойстве некоторых соединений, содержащих подвижный атом водорода в имидной группе, образовывать труднорастворимые соли серебра, что сопровождается выделением эквивалентного количества кислоты, которую определяют алкалиметрически. Метод является фармакопейным (теобромин) и используется во внутриаптечном контроле (теобромин, метилурацил, рибофлавин).
ф/кр
HNO3 + NaOH ––––––® NaNO3 + H2O Э = М.м.
|


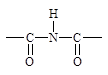 10-11. Лекарственные вещества, содержащие имидную
10-11. Лекарственные вещества, содержащие имидную  пиримидин-2,4,6-триона – барбитуратов (барбитал, фенобарбитал, бензонал, гексенал, тиопентал натрий); ксантина (теобромин); 5-нитрофурана (фурадонин).
пиримидин-2,4,6-триона – барбитуратов (барбитал, фенобарбитал, бензонал, гексенал, тиопентал натрий); ксантина (теобромин); 5-нитрофурана (фурадонин).
 Лекарственные вещества, содержащие сульфамидную группу, также являются слабыми кислотами, что обусловлено электроноакцепторными свойствами сульфогруппы и связанным с ними перераспределением электронной плотности. В соответствии с этим сульфамиды могут находиться в двух таутомерных формах.
Лекарственные вещества, содержащие сульфамидную группу, также являются слабыми кислотами, что обусловлено электроноакцепторными свойствами сульфогруппы и связанным с ними перераспределением электронной плотности. В соответствии с этим сульфамиды могут находиться в двух таутомерных формах.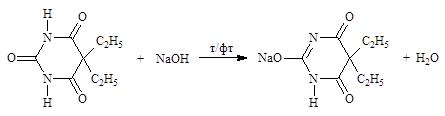 Алкалиметрический метод (вариант нейтрализации, способ прямого титрования). Основан на кислотных свойствах лекарственных веществ, содержащих имидную или сульфамидную группу. Определение проводят в водно-спиртовом или в водно-ацетоновом растворе, индикатор – тимолфталеин. Метод используется во внутриаптечном контроле (фенобарбитал, барбитал, норсульфазол).
Алкалиметрический метод (вариант нейтрализации, способ прямого титрования). Основан на кислотных свойствах лекарственных веществ, содержащих имидную или сульфамидную группу. Определение проводят в водно-спиртовом или в водно-ацетоновом растворе, индикатор – тимолфталеин. Метод используется во внутриаптечном контроле (фенобарбитал, барбитал, норсульфазол).
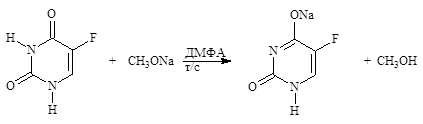
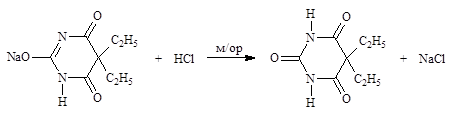

 1. Титрование без индикатора, конец титрования устанавливается по появлению устойчивой мути. Метод основан на образовании растворимой однозамещенной серебряной соли производных барбитуровой кислоты. Титрование должно проводиться в слабощелочной среде, для чего к анализируемому раствору добавляют натрия карбонат или натрия тетраборат.
1. Титрование без индикатора, конец титрования устанавливается по появлению устойчивой мути. Метод основан на образовании растворимой однозамещенной серебряной соли производных барбитуровой кислоты. Титрование должно проводиться в слабощелочной среде, для чего к анализируемому раствору добавляют натрия карбонат или натрия тетраборат. В точке эквивалентности избыточная капля титранта образует двузамещенную серебряную соль, которая нерастворима в воде (раствор мутнеет):
В точке эквивалентности избыточная капля титранта образует двузамещенную серебряную соль, которая нерастворима в воде (раствор мутнеет):