У НАСЫЩЕННОГО АТОМА УГЛЕРОДА
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В общем виде нуклеофильное замещение при насыщенном атоме углерода можно описать следующей схемой:
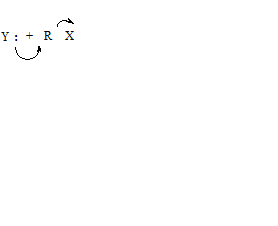
реагент субстрат продукт уходящая группа где Y – нуклеофильный реагент (основание Льюиса), R–X – субстрат (кислота Льюиса), Y–R – продукт замещения, X – уходящая группа.
Нуклеофильное замещение можно рассматривать и как кислотно-основное взаимодействие. Это взаимодействие сводится расщеплению ранее существовавшей связи С–Х и образованию новой связи С–Y. Эти процессы (расщепления и образования связей) могут протекать одновременно (синхронно) или протекать последовательно (асинхронно). Поэтому нуклеофильное замещение у насыщенного атома углерода можно представить в виде двух предельных случая: Асинхронный механизм (расщепление-присоединение), мономолекулярное нуклеофильное замещение SN1 (Substitution Nucleophilic unimolecular). Например, при гидролизе трет -бутилхлорида на первой медленной стадии происходит ионизация алкилгалогенида: k1
k –1 Затем происходит быстрое взаимодействие образовавшегося катиона с гидроксил-анионом: k2 (CH3)3C+ + –ОН (CH3)3C–ОН (быстро)
Лимитирующая стадия SN1 –механизма связана с увеличением числа частиц (рост разупорядочивания системы). Энтропия активации растет ∆S# > 0. Например, для гидролиза трет-бутилхлорида (CH3)3C–Cl ∆S# = +51 Дж/(моль . К).
Синхронный механизм, бимолекулярное нуклеофильное замещение SN2 (Substitution Nucleophilic bimolecular). Например, при щелочном гидролизе первичных алкилгалогенидов, нуклеофил (гидроксил-анион) поставляет свою электронную плотность для образования связи с углеродом, а уходящая группа (галоген) воспринимает на себя избыток электронной плотности. Образуется переходное состояние, в котором связь О–С еще полностью не сформировалась, а связь С–Х еще полностью не расщепилась:
НО– + –С–Х [ δ–НО … С … Х δ– ] HO–C– + X–
где Х = Галоген. Переходное состояние механизма SN2 предполагает определенную ориентацию реагирующих частиц – связано с упорядочиванием системы. Поэтому энтропия активации уменьшается ∆S# < 0. Например, при гидролизе метилхлорида CH3–Cl ∆S# = –17 Дж/(моль . К).
|





