Теплота. Энергия переноса массы
Работа A представляет собой энергию, передаваемую системой с изменением ее внешних параметров. Теплота Q тоже энергия, но передаваемая системе без изменения внешних параметров. Забегая вперед, можно написать, что элементарное количество теплоты, получаемое системой в равновесном процессе, равно произведению обобщенной силы T (температуры) на приращение обобщенной координаты S (энтропии):
δ Q = TdS. (13.1)
Энтропия – внутренний равновесный параметр системы. Аналогично, элементарное количество энергии переноса массы можно записать в виде
δ Z =
Здесь Ni – число частиц i -го компонента, μ ie – химический потенциал i -го компонента окружающей среды. При равновесном процессе химические потенциалы компонент системы и окружающей среды равны μ i = μ ie, так что
δ Z =
Как и работа, количества теплоты и энергии переноса массы зависят от процесса. Их элементарные количества (δ Q и δ Z соответственно) не являются полными дифференциалами (для них, как и для элементарной работы, вводится специальное обозначение). Если изменение состояния некоторой массы газа (закрытая система) происходит квазистатически при постоянном давлении, то работа, связанная с изменением объема, равна A = p (V 2 – V 1), и если не производится никакой другой работы, то из первого начала следует Q = U 2 – U 1 + p (V 2 – V 1). Удобно ввести функцию
H = U + pV, (13.3) называемую энтальпией, и записать
Q = H 2 – H 1,
т. е. изобарический подвод теплоты приводит к изменению энтальпии газа. Поэтому энтальпию называют еще тепловой функцией, или теплосодержанием.
|

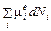 .
.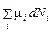 . (13.2)
. (13.2)


