Характеристики лекарственных композиций, полученных на основе фосфолипидной транспортной наносистемы
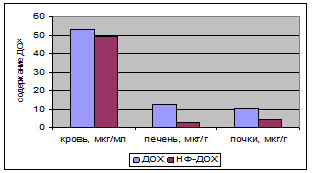
Биологические свойства лекарственных композиций на основе фосфолипидных наночастиц были изучены нами в экспериментах in vitro и in vivo. Исходя из того, что судьба лекарственных соединений в кровяном русле определяется характером их взаимодействия с компонентами крови, а также того, что эта связь во многом определяет дальнейшее поступление молекул лекарства в клетки-мишени, при разработке новых лекарственных средств особое внимание в последние годы обращают на их взаимодействие с компонентами крови (липопротеинами, белками, клеточными элементами). Связывание с белками и липопротеинами контролирует свободную, активную концентрацию лекарства, обеспечивает резервуар для его длительного действия и влияет на адсорбцию, распределение, метаболизм и экскрецию лекарства (тесно связанные меду собой процессы, часто рассматриваемые вместе и обозначаемые в литературе суммарной аббревиатурой ADME). В то же время, взависимости от лекарства, его механизма действия и характера взаимодействия с мишенью высокая афинность к плазменным белкам может быть или выгодной, или, наоборот, создавать препятствия для эффективности действия препарата. О важности определения степени взаимодействия лекарственной субстанции с компонентами крови свидетельствует также тот факт, что в FDA в 2002 г изучение распределения «лекарство – липопротеины» было включено как часть исследований при регистрации любого нового лекарства, включающего гидрофобные компоненты.Многие фармацевтические компании в настоящее время в своих программах разработки лекарств включают скрининг распределения лекарства по компонентам крови, особенно, если лекарство снабжено системами доставки. В связи с вышеизложенным, нами были проведены эксперименты in vitro с донорской кровью человека, в которых показано, что для ряда субстанций встраивание их в фосфолипидные наночастицы существенно изменяет распределение лекарства по компонентам крови. Так, например, включение доксорубицина в фосфолипидную транспортную наносистему по сравнению со свободным препаратом снижает его связывание с белками плазмы крови с 75% до 25%, но в 5 раз увеличивает встраивание во фракцию липопротеинов высокой плотности (ЛВП). Анализ распределения лекарственных субстанций по компонентам крови проводили после инкубации препаратов в течение 30 мин при 37˚С. Аналогичное исследование для индометацина в составе фосфолипидных наночастиц показало десятикратное увеличение встраивания лекарства во фракцию липопротеинов очень низкой (ЛОНП) и низкой плотности (ЛНП) по сравнению со свободной субстанцией, но снижение встраивания в белковую фракцию приблизительно на 20%. Как известно, в фармакологии существует понятие относительной биодоступности лекарственных препаратов, которая представляет собой величину, определяющую относительную степень всасывания лекарственного вещества из испытуемого препарата по отношению к всасыванию лекарственного вещества из препаратов сравнения. Нами проведены эксперименты на животных по определению относительной биодоступности некоторых из разработанных лекарственных композиций на основе фосфолипидной транспортной наносистемы. Исследования показали, что подобная модификация формы лекарственного препарата приводит к изменению таких фармакокинетических характеристик, как AUCt (площадь под кривой концентрации в плазме/время), tмакс. 1/2 (время достижения максимальной концентрации в крови при несосудистом введении), t1/2 (время полувыведения субстанции из кровотока). Например, при пероральном введении крысам препаратов липоевой кислоты время достижения половины максимальной концентрации t1/2 составило для липоевой кислоты в составе фосфолипидных наночастиц 45 мин. против 90 минут для свободной липоевой кислоты. Липоевая кислота, введенная внутривенно в виде 4%-ного спиртового раствора, выводится из кровотока в течении 30 минут, в то время как введенная в составе фосфолипидных наночастиц обнаруживается в крови вплоть до 3 часов. Исследования показали, что полученная нами композиция на основе липоевой кислоты и фосфолипидной транспортной наносистемы хорошо растворима в воде и обладает большей биодоступностью при пероральном введении, а при внутривенном введении – дольше циркулирует в кровотоке. Доксорубицин (ДОХ) эффективен против широкого спектра злокачественных новообразований. В связи с этим постоянно предпринимаются попытки создания новых форм этого препарата с целью улучшить терапевтический индекс ДОХ и снизить его побочные эффекты (прежде всего кардиотоксичность). В экспериментах на животных (крысы и мыши с привитой саркомой Льюиса) нами было показано, что хотя кинетика элиминации ДОХ из кровотока при внутривенном введении для доксорубицина (производство ЛЭНС) и фосфолипидной композиции на основе ДОХ совпадают, но ряд характеристик свидетельствуют в пользу ДОХ, введенного в кровоток в составе фосфолипидных наночастиц. На рис. 9 представлены результаты по сравнению накопления ДОХ в печени и почках через 10 минут после внутривенного ведения ДОХ в двух формах: в свободном виде и в составе фосфолипидной транспортной наносистемы (ФТН-ДОХ): в печени и почках содержание ДОХ при введении ФТН-ДОХ меньше, чем при введении свободного доксорубицина.
Рис. 9 – Сравнение содержания ДОХ в крови, печени и почках крыс через 10 минут после внутривенного введения ДОХ и ДОХ в составе фосфолипидных наночастиц.
Как видно из рис.9, содержание ДОХ-ФТН в печени крыс через 10 мин. после введения было приблизительно в 3 раза меньше, чем свободного препарата; в почках – в 2 раза меньше. В экспериментах на мышах с привитой саркомой Льюиса было показано, что при введении ДОХ-ФТН накопление доксорубицина в опухолевой ткани было в 3 раза выше, чем при использовании свободного доксорубицина. Таким образом, можно предположить, что ДОХ, введенный в кровоток в составе фосфолипидных наночастиц, будет эффективно проникать в опухолевую ткань, вызывая гибель клеток опухоли, в меньшей степени оказывая токсическое действие на здоровые ткани. Оценка противоопухолевой активности доксорубицина, встроенного в фосфолипидную транспортную наносистему была проведена в эксперименте на мышах линии С57 В1/6 с перевитой карциномой Льюиса. Инъекционные растворы цитостатиков вводили мышам внутрибрюшинно, вводимая доза по доксорубицину (5 мг/кг) составляла половину максимально переносимой дозы, равной 10 мг/кг веса тела. Результаты опытов оценивали в соответствии с общепринятыми в экспериментальной онкологии международными и отечественными критериями. Одним из показателей эффективности лечения является индекс торможения роста опухоли (ТРО): ТРО, % = ((Vк-Vо)/Vк) × 100, где Vк - средний объем опухоли в контрольной группе; Vо – средний объем опухоли в опытной группе. Таким образом, при сравнении двух опытных групп, чем больше индекс ТРО, тем эффективность используемого в этой группе препарата выше. Результаты, характеризующие сравнительную эффективность свободного доксорубицина и доксорубицина в фоставе фосфолипидной транспортной наносистемы приведены в таблице 3. Предварительные результаты исследования противоопухолевой эффективности лекарственной композиции доксорубицина на основе фосфолипидной транспортной наносистемы показали, что полученный препарат проявляет значительную противоопухолевую активность, превосходя по эффективности препарат сравнения (доксорубицин производства ЛЭНС) при сопоставимой переносимости (работа выполнялась в рамках Государственного контракта от «07» июня 2007г. № 02.522.11.2011). Таблица 3. Сравнительная эффективность трехкратного введения препаратов доксорубицина с интервалом 7 дней после трансплантации опухоли (первое введение на 7 день после трансплантации опухоли)
**- достоверно по отношению к контролю и к показателям группы, которой вводили доксорубицин, * - достоверно по отношению к контролю
Необходимо отметить, что представлены результаты предварительных исследований; изучение дозозависимых свойств препаратов на данный момент времени не проводилось. В настоящее время такие композиции, как доксорубицин-ФТН, индометацин-ФТН, хлорин Е6-ФТН находятся в стадии доклинических исследований. На лекарственные композиции доксорубицин-ФТН, индометацин-ФТН, хлорин Е6-ФТН разработаны проекты нормативно-технической документации и наработаны опытно-промышленные партии образцов (по 500 упаковок №6 для каждого наименования). Учитывая вышеизложенные результаты проделанной работы для реализации проекта «Организация производства нанолекарств на основе растительных фосфолипидов» потребуется решить следующие задачи, связанные с НИР: 1. Разработать формы готовых препаратов (инъекции, капсулы, таблетки и др.) на основе заявленных в проекте лекарственных композиций. 2. Провести клинические испытания разработанных форм готовых лекарственных препаратов в соответствии с рекомендациями и требованиями МЗ СР РФ. 3. Актуализировать нормативно-техническую документацию для конкретного производства и оборудования.
Учитывая, что целью проекта является организация производства лекарств нового поколения (нанолекарств), снабженных фосфолипидной системой транспорта, для реализации проекта необходимо решить ряд задач, связанных с ОКР. А именно необходимо: - разработать проектную документацию для организации опытно-промышленного производства нанолекарств; - оптимизировать основные этапы технологического процесса «привязав» их к конкретному производству и оборудованию; - провести лицензирование нового производства.
|