Обоснование НИОКР
В Государственном учреждении научно-исследовательский институт биомедицинской химии Российской Академии Медицинских Наук разработан и внедрен в медицинскую практику лекарственный препарат нового поколения Фосфоглив, инъекционная форма которого представляет собой фосфолипидные наночастицы диаметром не более 50 нм. Коллективом авторов разработана технология промышленного производства и вся необходимая научно-техническая документация, разрешающая выпуск капсульной и инъекционной (внутривенной) форм Фосфоглива. В 2001-2004гг в институте организовано опытно-промышленное производство и получена лицензия, разрешающая выпуск капсульной и инъекционной форм препарата. Технология производства инъекционной формы Фосфоглива относится к нанотехнологиям и не имеет аналогов в РФ. В 2002 году эта разработка была отмечена премией Правительства РФ. Все это свидетельствует о том, что коллектив имеет положительный опыт не только в разработке лекарственных препаратов и необходимой нормативно-технической документации, а также в организации их производства и выпуске. Коллектив ГУ НИИ БМХ РАМН, состоящий из научных сотрудников, фармацевтов, технологов и других специалистов располагает современным лабораторным оборудованием, необходимым для работы с синтетическими и природными фосфолипидами. С 2007 года работы в этом направлении ведутся в рамках Государственного контракта № 02.522.11.2011 от «07» июня 2007г., заключенного с Федеральным агентством по науке и инновациям, по теме «Разработка фосфолипидной транспортной системы и технологии включения в ее состав лекарственных субстанций». На основе анализа данных литературы и собственного опыта работы с фосфолипидами и фосфолипидными наночастицами (мицеллами/липосомами) нами была разработана лабораторная технологии получения стабильной при хранении фосфолипидной транспортной наносистемы (ФТН) и включения в ее состав различных лекарственных субстанций. Технология была масштабирована в рамках опытно-промышленного производства института, подобраны и оптимизированы условия проведения каждого этапа, осуществлен подбор криопротектора с целью получения указанных композиций в виде лиофильно высушенного порошка, полностью сохраняющего свои свойства при регидратации. В качестве способа получения нанодисперстных эмульсий фосфолипидов и их композиций с различными лекарственными субстанциями был выбран метод гомогенизации либо с использованием поршневой системы, в которой грубая суспензия продавливается под высоким давлением сквозь клапан с регулируемым зазором (гомогенизатор высокого давления Mini – Lab 7.30 VH, Rannie, Дания), либо с использованием микрофлуодайзера (Microfluidizer Processor M110 EN-30, США) – установки, позволяющая быстро и воспроизводимо получать большие объемы фосфолипидных наноэмульсий с малым размером частиц в строго контролируемых условиях без использования озвучивания, детергентов, органических растворителей. Запатентованная технология, используемая в микрофлуодайзере состоит в последовательном пропускании обрабатываемой эмульсии через керамические камеры специфической конфигурации со скоростью более 500 м/сек. В настоящее время за рубежом этот метод широко применяется в фармацевтической, косметической, пищевой, химической и др. отраслях промышленности (патенты United States Patent 5607622, United States Patent 5720802, US Patent 6135628 и т.д.), в том числе для получения фосфолипидных липосом (United States Patent 4622188). Данные о воспроизводимости размера частиц в фосфолипидной наноэмульсии полученной с помощью микрофлюадайзера (M-110EH-30, Microfluidics) в разных лабораторных и опытно-промышленных сериях образцов представлены в таблице 1. Анализ проводили с помощью лазерного корреляционного спектрометра Beckman-Coulter N5 после растворения в воде лиофильно высушенных образцов, т.е. после окончания всего технологического процесса получения порошка фосфолипидных наночастиц. Таблица 1. Диаметр фосфолипидных наночастиц в образцах ФТС.
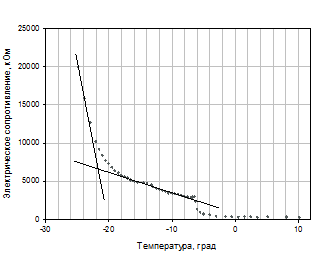
Приведенные данные показывают, что размер частиц фосфолипидной наноэмульсии не превышает 25 нм, а технология воспроизводима как в лабораторных, так и в опытно-промышленных условиях. Среди различных способов сушки, применяемых в фармацевтической промышленности (вакуумной, распылительной, в псевдоожиженном, фонтанирующем слое и других гидродинамических режимах), наибольшее распространение получила вакуумная сублимационная сушка при отрицательных температурах. Сублимационная сушка (сушка вымораживанием, молекулярная сушка, или лиофильная) наиболее популярный и стремительно развивающийся технологический процесс нескольких последних десятилетий. Наиболее широко он применяется в пищевой и фармацевтической отраслях для высушивания термолабильных и легко окисляющихся биологически активных соединений, клеточных культур, микроорганизмов и т.д. В технологии получения фосфолипидной транспортной системы и лекарственных композиций на ее основе в виде сухого порошка процесс сушки имеет важное значение, т.к. для производства используются легкоокисляемые фосфолипиды, а получаемые наночастицы являются термочувствительными. В ходе выполнения работ по Государственному контракту № 02.522.11.2011 были разработаны и оптимизированы технологические условия проведения процесса лиофилизации фосфолипидных наноэмульсий с целью получения сухого порошка фосфолипидных наночастиц, стабильных при хранении и сохраняющих физико-химические свойства при регидратации. Cублимационная сушка имеет три основные стадии: предварительное замораживание продукта, удаление из продукта замороженной влаги путем сублимации (период постоянной скорости сушки), удаление невымороженной (связанной) влаги с повышением температуры до допустимого уровня (период падающей скорости сушки). Все стадии энергозатратны, и оптимизация каждой из них снижает временные и материальные затраты. Стадия предварительного замораживания осуществляется при понижении давления и с определенной скоростью понижения температуры. Считается, что наилучший вариант – это быстрая заморозка, способствующая образованию наиболее мелких кристаллов (Нежута А.А., 2005). На скорость замораживания существенно влияют условия теплообмена и параметры самого материала. Граница снижения температуры определяется температурой эвтектики – температурой, при которой наступает полная кристаллизация подлежащего высушиванию материала (В.И. Чуешов, 2002). Для определения точки эвтектики был проведен анализ зависимости электрического сопротивления наноэмульсии фосфолипидных частиц от температуры при его разморозке (рис. 1).
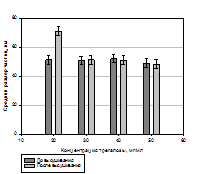
Рис. 1 - Анализ зависимости сопротивления эмульсии фосфолипидных наночастиц от температуры при ее размораживании. Оптимизацию процесса лиофильной сушки осуществляли на основании анализа термограмм процесса. Основным регулируемым параметром является температура полки (на промышленной установке - температура теплоносителя, определяющего температуру полки). В качестве исходного режима сублимационной сушки фосфолипидной транспортной наносистемы был принят соответствующий процесс, применяемый при производстве инъекционной формы лекарственного препарата «Фосфоглив», разработанного в ГУ НИИ БМХ РАМН. Нами было показано, что плавное повышение материала приводит к превышению температуры эвтектики до окончания стадии сублимации, вызывая частичное плавление содержимого флакона и появлению следов кипения в материале. Для получения высококачественного продукта было предложено температуру полки поддерживать на постоянном уровне. Величина остаточной влажности в значительной степени влияет на стабильность сухого препарата в процессе хранения. По окончании стадии сублимации содержание влаги в продукте не превышает 6%. Процесс досушивания (снижение влагосодержания до уровня ≤ 0.1–0.5%) происходит при дополнительной подаче тепла до температуры сублимации допустимой характеристикой термолабильности продукта. В результате этого этапа работы были подобраны такие условии лиофильной сушки, которые позволили при сохранении качества получаемого препарата сократить ее время на пилотной установке с 72 до 27 часов. Применение разработанных и опробованных на пилотной установке параметров дает возможность значительно сократить время сушки на промышленной установке, что, в свою очередь, приведет к ощутимой экономической выгоде. Получение фосфолипидной транспортной наносистемы в виде лиофильно высушенного порошка невозможно осуществить без использования криопротектора, роль которого заключается в сохранения физико-химических свойств (в частности, размера) наночастиц в процессе лиофильной сушки с последующим их воспроизведением при регидратации. Выбор криопротектора определяет скорость и продолжительность сублимационной сушки (Нежута А.А.,2005). В качестве криопротекторов при высушивании фосфолипидных частиц используются в основном сахара. Нами было проведено сравнительное исследование криопротекторных свойств наиболее часто применяемых сахаров: мальтозы, лактозы и тригалозы. На рисунке 2 приведены результаты сравнительных исследований криопротекторных свойств мальтозы, глюкозы и трегалозы.
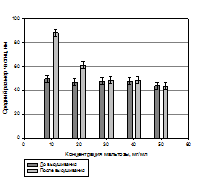
Рис. 2 - Влияние содержания трегалозы, лактозы и мальтозы на воспроизведение размера частиц фосфолипидной транспортной наносистемы после регидратации.
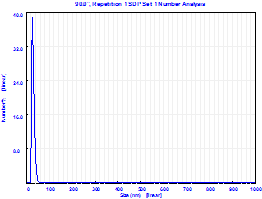
Проведенные сравнительные исследования криопротекторных свойств сахаров показали, что мальтоза, лактоза и трегалоза обладают сопоставимыми свойствами. Однако, учитывая, что мальтоза применяется в фармацевтической промышленности, в частности, при производстве инъекционной формы препарата «Фосфоглив», было принято решение об использовании именно мальтозы в качестве криопротектора при производстве фосфолипидной транспортной наносистемы и лекарственных композиций на ее основе. Немаловажным этапом технологического процесса получения лекарственных препаратов на основе фосфолипидной транспортной системы с предельно малым диаметром частиц (до 30 нм) является стадия фильтрации: фосфолипидная наноэмульсия, прошедшая стадию гомогенизации, подвергается стерилизующей и стандартизирующей фильтрации через фильтр с размером пор 0,22 мкм. Разработанная нами технология дает возможность получать фосфолипидные наночастицы, в которые могут быть включены как гидрофобные, так и гидрофильные лекарственные соединения. Основными показателями качества частиц транспортной системы являются следующие физико-химические характеристики: размер частиц, прозрачность раствора, агрегационная устойчивость частиц, процентное содержание лекарственных субстанций в фосфолипидных наночастицах. Согласно данным лазерной корреляционной спектроскопии разработанный лабораторный регламент, включающий стадию фильтрации через фильтр с размером пор 220 нм, позволяет получать фосфолипидные наноэмульсии с преимущественным диаметром частиц до 25 нм. Размер фосфолипидных наночастиц определяли двумя методами: (1)методом фотонной корреляционной спектроскопии и (2)методом атомно-силовой зондовой микроскопии. Размер фосфолипидных наночастиц первым методом определяли на приборе «Beckman N5 Submicron Particle Size Analyzer» («Beckman Coulter, Inc.», США), с соответствующим программным обеспечением. Автокорреляционную функцию светорассеяния получали, используя гелий-неоновый лазер (длина волны λ=632,8 нм) мощностью 25 мВт при угле рассеяния 90°. На рисунке 3 показано характерное распределение частиц (монодисперсный анализ) по размерам для образца фосфолипидной транспортной наносистемы (ФТН).
Рис. 3 - Характерное распределение частиц по диаметру (монодисперстный анализ).
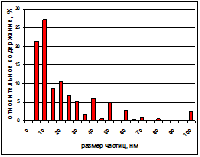
Из рисунка 3 видно, что средний диаметр частиц 43,4 нм (положение максимума кривой монодисперсного распределения). Однако для данного спектра индекс полидисперстности (ИП) – отклонение от линейности автокорреляционной функции в полулогарифмических координатах – равняется 0,32 более корректно проводить анализ с позиции полидисперсного распределения. Анализ автокорреляционной функции с позиции полидисперстности образца (в нашем случае ИП=0,32) производится автоматически согласно встроенному программному обеспечению и показывает вклад частиц разного диаметра в интенсивность рассеяния и долю (процент) каждого пула частиц. На рисунке 4 приведено полидисперсное распределение частиц по фракциям того же образца, что и на рис. 3. Как видно, 99,97% наночастиц имеют диаметр (27,3 ± 3,5) нм и только 0,03% - 97,1 нм. Вклад более крупных частиц сдвигает максимум кривой монодисперсного распределения (по интенсивности рассеяния) в сторону частиц с большим диаметром (до 43,4 нм).
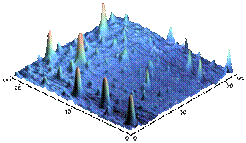
Рис. 4 - Анализ распределения по размерам с позиции полидисперстности образца. Таким образом, в свежеприготовленной эмульсии фосфолипидной транспортной наносистемы содержится более 99,9% частиц диаметром около 25 нм и менее 0,1% частиц с размером не более 100 нм. Использование атомно-силового микроскопа подтверждает данные лазерной корреляционной спектроскопии: показано, что более 90% частиц наноэмульсии фосфолипидной транспортной наносистемы имеют размер до 30 нм. Полученные и визуализированные с помощью атомно-силового микроскопа фосфолипидные частицы и распределение фосфолипидных наночастиц в образце в соответствии с их диаметром представлены на рис. 5.
Рис. 5 - АСМ – изображение фосфолипидных наночастиц на поверхности слюды (слева) и распределение фосфолипидных наночастиц по размеру.
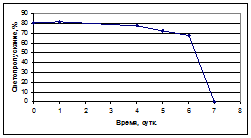
Таким образом, по результатам атомно-силовой микроскопии видно, что большинство частиц имеет размеры в диапазоне от 8 до 25 нм. После регидратации лиофильно высушенных образцов в полученной эмульсии фосфолипидной транспортной наносистемы, диаметр частиц соответствовал данным, полученным для исходных препаратов, частиц диаметром выше 200 нм не содержалось вообще. Безусловным фактором, определяющим качество конечного продукта, является стабильность фосфолипидных наночастиц в растворе. Об агрегационной устойчивости частиц судили по изменению прозрачности (светопропускания) раствора при длине волны 660 нм непосредственно после гомогенизации и через 1, 4, 5, 6 и 7 суток хранения эмульсии при комнатной температуре в закрытом флаконе из темного стекла (рис. 6).
Рис.6 - Зависимость светопропускания раствора фосфолипидной наноэмульсии при хранении.
Из представленного выше графика видно, что заметная агрегация частиц происходит только после 6-ти суток хранения фосфолипидной наноэмульсии при комнатной температуре. Хранение в сухом виде в течение 12-ти месяцев также заметно не изменяло эти характеристики. Необходимо отметить, что столь длительное хранение водных эмульсий лекарственных препаратов не предусмотрено, т.к. способ использования лекарственной формы не предусматривает хранения препарата в растворенном виде. Таким образом, в условиях опытно-промышленного участка была разработана и масштабирована технология получения стабильной при длительном хранении (в том числе при комнатной температуре) фосфолипидной транспортной системы с диаметром частиц 20-25 нм. Все вышеперечисленное позволяет нам утверждать, что технология производства отработана и представленный проект организации производства нанолекарств на основе фосфолипидной транспортной системы наиболее подготовлен для внедрения. В случае организации промышленного выпуска других лекарственных композиций на основе фосфолипидной транспортной наносистемы в условиях конкретного производства предлагаемая нами технология нуждается в дополнительной оптимизации всех этапов технологического процесса. Однако это не связано с переоборудованием производства, не изменяет последовательность технологических этапов в целом, а, следовательно, не требует больших экономических затрат. Значительное количество из уже существующих лекарственных субстанций, а также находящихся в стадии разработки, нерастворимы в воде, т.е. гидрофобны. Из-за плохой растворимости биодоступность гидрофобных лекарств, как правило, чрезвычайно низка. Для повышения эффективности таких лекарственных субстанций разработчики пытаются найти способы повышения их растворимости путем модификации молекулы или создания новых лекарственных форм существующих лекарств без изменения их эффективности. Одним из направлений в решении этих задач является снабжение гидрофобных лекарственных соединений системами транспорта в организме к органам, тканям, клеткам-мишеням. Липосомы, получаемые из фосфолипидов, были одними из первых систем транспорта биологически активных соединений (Voinea M, 2002). В настоящее время работы в этом направлении ведутся во многих лабораториях. Ряд липосомальных лекарств уже нашли практическое применение, в частности – в онкологии. Анализ литературы показывает, что фосфолипидные наночастицы различного состава являются в настоящее время преобладающей формой в конструировании систем доставки лекарств для повышения их биодоступности, снижения побочных проявлений, увеличения терапевтической эффективности. Основой при разработке технологии включения в состав фосфолипидных наночастиц лекарственных субстанций стала разработанная нами лабораторная технология получения фосфолипидной транспортной наносистемы (ФТН). Как и для производства ФТН в качестве исходного компонента был выбран фосфатидилхолин из растительных фосфолипидов (Lipoid S100). При выполнении Государственного контракта № 02.522.11.2011 нами показано, что стабильная высокодисперсная наносистема, полученная на основе соевого фосфолипида представляет собой универсальную систему для транспорта в организме ряда биологически активных соединений как жирорастворимых (гидрофобных), так и водорастворимых (гидрофильных). На основании проведенного скрининга лекарственных субстанций разного спектра действия была проанализирована способность их встраивания в фосфолипидную транспортную наносистему, определены основные принципы и разработана технологическая схема получения лекарственных композиций с заданным размером частиц, отработан метод для характеристики процента встраивания субстанции в фосфолипидные наночастицы. Последний параметр является весьма важным, т.к. от количества лекарственного соединения, включенного в фосфолипидные наночастицы, существенно зависит терапевтическая эффективность получаемой лекарственной формы. Для определение процента содержания лекарственных субстанций в фосфолипидных наночастицах в полученных образцах лекарственных композиций необходимо прежде всего разделить свободную субстанцию от субстанции в составе ФТН. Метод гельфильтрации в том или ином варианте широко используется различными исследователями для разделения фосфолипидных наночастиц, содержащих лекарство от свободного лекарства. Серьезным недостатком этого метода является значительное неконтролируемое разбавление исследуемого раствора, что серьезно затрудняет количественный анализ. Другой недостаток метода связан с существенной сорбцией фосфолипидного материала практически на всех матрицах для гельфильтации, включая сефадексы. Определение после гельфильтрации с помощью ВЭЖХ количества лекарственного соединения, включенного в фосфолипидные наночастицы, связано с необходимость концентрировать материал, что, в свою очередь, затрудняет анализ и увеличивает ошибку. В целом ошибка метода достигает примерно 20-30%. Примеры использования метода гельфильтрации для разделения фосфолипидных везикул с лекарствами от лекарства свободного описаны в ряде статей (Lopes, 2004; Fry, 1978; Essa, 2002). Процедура занимает значительное время и малопригодна при проведении серии анализов. В связи с этим нами был применен и адаптирован метод ультрафильтрации. Модифицированный нами способ определения процента встраивания лекарства в ФТН, представляет собой комбинацию двух известных методов: ультрафильтрации и ВЭЖХ-анализа, которые, по нашим данным для этих целей в таким сочетании ранее не применялись. Для анализа раствор образца помещается в специальный патрон, дно которого представляет собой калиброванную мембрану, задерживающую частицы с молекулярной массой 10000 (для примера, диаметр молекулы цитохрома С около 3 нм, М.в. 12000 Da). При последующем центрифугировании (2000 g) фосфолипидные наночастицы и лекарственная субстанция, включенная в них задерживаются мембраной картриджа. Субстанция не связанная с частицами проходит через мембрану. Затем методом ВЭЖХ анализируется содержание лекарственной субстанции в фильтрате. Таким образом, определив количество субстанции в исходном препарате и в фильтрате можно установить % содержания той или иной лекарственной субстанции в составе фосфолипидной транспортной наносистемы. В таблице 2 приведены физико-химические характеристики ряда полученных таким образом препаратов.
Таблица 2.
|