Класифікація ПАР.
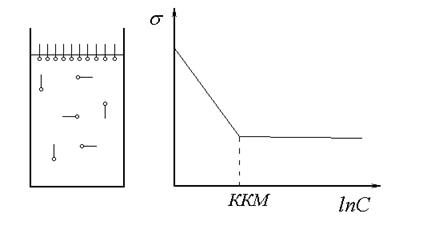
За здатністю до дисоціації ПАР поділяються на іоногенні та неіоногенні. В свою чергу іоногенні ПАР поділяються на аніонітні, катіонітні та амфолітні або амфотерні. Аніонітні ПАР дисоціюють у воді з утворенням поверхнево-активного аніона. До них відносяться: карбонові кислоти та їх солі RCOOH R=(C10-C22); RCOOM M=(Na, K) алкілсульфонати RSO3M алкіларілсульфонати RarSO3M Катіонітні ПАР дисоціюють з утворенням поверхнево активного катіона, це: солі амінів RNH3Cl; R2NH2Cl; R3NCl Амфолітні ПАР мажуть утворювати при дисоціації, поверхнево – активні іони різного знаку, в залежності від рН середовища. До них відносяться амінокислоти RNH(CH2)nCOOH Неіоногенні ПАР в розчинах не дисоціюють, до них відносяться спирти та похідні оксиду етилену. ROH; R(OCH2CH2)nOH За розчинністю ПАР поділяють на істино розчинні та колоїдні. Істинно розчинні ПАР це дифільні органічні сполуки з невеликим вуглецевим радикалом, наприклад нижчі спирти, феноли, кислоти та їх солі. Ці речовини знаходяться в розчині в молекулярно – дисперсійному стані до концентрації, що відповідає їх насиченому розчину. При подальшому збільшені концентрації система розділяється на дві окремі фази. Колоїдні ПАР мають малу розчинність та здатні сильно зменшувати поверхневий натяг адсорбуючись на поверхні розділу фаз. При дуже малих концентраціях колоїдні ПАР утворюють істині розчини. Але при деякій концентрації, яку називають критична концентрація міцелоутворення (ККМ) ПАР починають утворювати агрегати молекул. Внаслідок цього загальна розчинність ПАР зростає, тоді як молекулярна розчинність залишається незмінною і дорівнює ККМ.
Рис. 69. Визначення ККМ для колоїдних ПАР.
|