НОВАЯ ГЕТЕРОЦИКЛИЗАЦИЯ ПРИ ВЗАИМОДЕЙСТВИИ ХЛОРАЦЕТИЛЕНФОСФОНАТОВ С 4-АМИНО-3-МЕРКАПТО-5-АЛКИЛ-1,2,4-ТРИАЗОЛАМИ
Эрхитуева Е.Б.,1 Догадина А.В.2,Храмчихин А.В.3
1 Санкт-Петербургский государственный технологический институт (технический университет), Санкт-Петербург, Россия. Аспирант 3г. serlxa@yandex.ru 2 Санкт-Петербургский государственный технологический институт (технический университет), Санкт-Петербург, Россия.. 3 Санкт-Петербургский государственный технологический институт (технический университет), Санкт-Петербург, Россия.. Научный руководитель: Ионин Б.И.
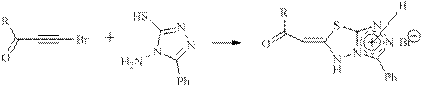
Известно, что многие конденсированные гетероциклические соединения, содержащие триазольный цикл, обладают разнообразными фармакологическими свойствами, такими как болеутоляющие, противовоспалительные, противоопухолевые, антибактериальные, радиопротекторные и др. [1, 2]. К настоящему времени фосфорсодержащие соединения подобной структуры неизвестны. Хотя сочетание конденсированных гетероциклов и фосфонатной группы в одной молекуле может привести к еще большему многообразию ценных биологических свойств. В литературе [3, 4] было показано, что реакции галогенацетиленов, в том числе хлорацетиленфосфонатов, с бинуклеофильными реагентами проходят с атакой обоих нуклеофилов по углеродному атому, связанному с хлором, и приводит к образованию различных фосфорилированных гетероциклических соединений, типа имидазолов, оксазолов, тиазолов и т.п. Такое же направление реакции наблюдается в исследованиях реакции 1-бром-2-ацилацетиленов с 4-амино-3-меркапто-5-фенил-1,2,4-триазолом [5]:
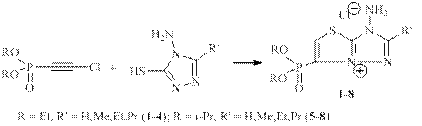
Нами установлено, что реакция хлорацетиленфосфонатов с 4-амино-3-меркапто-5-алкил-1,2,4-триазолами легко проходит в ацетонитриле при комнатной температуре при смешении эквивалентных количеств исходных реагентов с образованием конденсированных гетероциклических соединений необычной структуры, а именно 3-амино-6-(диалкоксифосфорил)-2-алкил-3H-тиазоло[3,2-b][1,2,4]триазол-7-илия хлоридов (1-8):
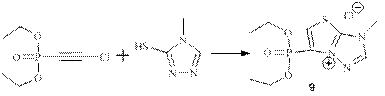
Образование тиазолиевых хлоридов (1-8) проходит через циклизацию с участием второго атома N триазольного кольца, а аминогруппа не принимает участия в гетероциклизации. Соединения (1-8) – кристаллические вещества, плохо растворимые в органических растворителях и достаточно хорошо растворимые в воде. В спектрах ПМР соединений (1-8) олефиновый протон резонирует в слабом поле δ ≈ 8.5-8.7, 3JHP ≈ 8.0 Гц. В спектрах ЯМР 13C первый углеродный атом, связанный с фосфорной группой, резонирует в слабом поле дублетным сигналом малой интенсивности δ ≈ 124.0-125.0, с характерной константой 1JCP ≈ 216.0-218.0 Гц. Углерод группы =CH тиазольного кольца представлен в спектре интенсивным дублетным сигналом δ ≈ 130.0-132.0, с малой константой расщепления от фосфора 2JCP ≈ 14.0-16.0 Гц. Соединения аналогичной структуры получены в реакции хлорацетиленфосфонатов с 4-метил-3-меркапто-1,2,4-триазолом.
Основные параметры спектров ЯМР для соединения 9: δP -1.02 м.д.; δCH= 8.54, 2JHP 8.0 Гц; δC-P 124.27, 1JCP 219.3 Гц; δCH= 133.14, 2JCP 17.1 Гц. Строение полученных соединений (1-9) доказано спектроскопией ЯМР на ядрах 1H, 13C, 31P, 15N и данными рентгеноструктурного анализа и масс-спектрометрии (HRMS).
Литература: [1] Ghorab M.M., Hassan A.Y. Phosphorus, Sulfur, and Silicon. 141, 251-260 (1998) [2] Rasad A.R., Ramalingamat T., Rao A.B., Diwas P.W., Sattur P.B. Indian J. Chem.25B, 556 (1986) [3] Петров А.А., Догадина А.В., Ионин Б.И., Гарибина В.А., Леонов А. А. Успехи химии. 52, 1793 (1983) [4] Zhang, Ming-Tian; Irebo, Tania; Johansson, Olof; Hammarstroem, Leif. J. Am. Chem. Soc. 34, 13224-13227 (2011) [5] Глотова Т.Е., Нахманович А.С., Сигалов М.В. ЖОрХ, 24, вып. 10, 2151-2156 (1988) СТРУКТУРНЫЕ ОСОБЕННОСТИ ИЗОНИТРИЛЬНЫХ КОМПЛЕКСОВ ПАЛЛАДИЯ (II)
Якиманский А.А.
Санкт-Петербургский государственный университет, Санкт-Петербург, Россия. Студент III курса. yakimanskii@yahoo.com Научный руководитель: Боярский В.П.
В последнее время ациклические диаминокарбеновые комплексы палладия стали все шире использоваться в качестве катализаторов реакций кросс-сочетания. Одним из методов получения таких катализаторов служит взаимодействие бис -изонитрильных комплексов хлорида палладия (II) с азотистыми нуклеофилами, в частности, с бензофенонгидразоном [1]. Это обусловило возросший интерес к свойствам подобных бис -изонитрильных комплексов. Данная работа посвящена структуре и поведению в растворе бис- (циклогексилизонитрил)палладий дихлорида (1), являющегося прекурсором для получения весьма эффективного катализатора реакции Сузуки [1]. Этот комплекс кристаллизуется из раствора в виде цис -изомера (по данным РСА [2]). Однако нами был обнаружено, что этот изонитрильный комплекс в растворе в СDCl3 способен давать два различных набора сигналов в спектре ЯМР 1Н, причем соотношение этих сигналов варьировалось в зависимости от условий опыта. Это можно было бы объяснить переходами в растворе между цис - и транс - формами комплекса.
Учитывая, что катализатором кросс-сочетания служит цис -форма диаминокарбенового комплекса, необходимо было проверить наличие равновесия между цис - и транс - изомерами комплекса 1, а также возможность получения транс -карбеновых продуктов. Методом ИК спектроскопии и спектроскопии ЯМР 1Н мы изучили влияние временного фактора на содержание изомеров в растворе. Было обнаружено, что при растворении чистого образца кристаллического цис -изомера комплекса 1 в спектре присутствует один набор сигналов. Через некоторое время появляются сигналы другого изомера, интенсивность которых постепенно увеличивается. По данным ИК спектроскопии было показано, что новые сигналы соответствуют транс -изомеру комплекса 1. Через 10 дней при комнатной температуре соотношение между изомерами перестало меняться, очевидно, достигнув равновесного значения (2:1 в пользу цис -изомера). Важно отметить, что при наложении серии спектров, снятых с одного и того же раствора бис- циклогексилизонитрильного, на суммарной картинке присутствует изобестическая точка, что говорит о наличии в системе равновесия. Равновесие достигается медленно, однако выходы реакций комплекса 1 велики (80-90%), поэтому мы предположили, что в присутствии азотсодержащего нуклеофила (основания) достижение равновесия ускоряется. Чтобы проверить это, мы смоделировали условия реакции получения карбенового комплекса (использовался пара -анизидин), оказалось, что равновесное соотношение изомеров достигается практически мгновенно после смешения комплекса 1 с азотсодержащим нуклеофилом (основанием).Кроме того, был поставлен эксперимент с участием азотистого основания, не вступающего в реакцию образования карбеного комплекса (пиридин) – равновесие было достигнуто в течение часа. Так же было изучено влияние температуры на положение равновесия и скорость его достижения. Таким образом, было изучено поведение изонитрильных комплексов хлорида палладия (II) в растворе, доказано существование равновесия между изомерными цис- и транс- формами и выявлен круг факторов, влияющих на скорость установление данного равновесия и его положение.
Литература: [1] Luzyanin K. V., Tskhovrebov A. G., Maia M. C., Guedes da Silva M. F. C., Kukushkin V. Yu., Pombeiro A. J. L., Organometallics, 28, 6559–6566, (2009) [2] Kitano Y., Hori T. Acta Crystallogr., Sect.B: Struct.Crystallogr.Cryst.Chem., 37, 1919, (1981)
* Здесь указан выход после перекристаллизации, в скобках – после колонки [1] представлены наиболее выгодные конформационные состояния
|