Равновесие фаз, фазовые переходы. Уравнения Клапейрона-Клаузиуса.
Газ, жидкость, твердое тело – основные агрегатные состояния вещества. В газах все молекулы участвуют в хаотическом тепловом движении, поэтому упорядоченность в расположении молекул отсутствует. В твердых телах молекулы или атомы совершают колебательное движение около положений равновесия. В жидкости каждая молекула в течение некоторого времени колеблется около определенного положения равновесия, после чего скачком переходит в новое положение, отстоящее от исходного на расстоянии порядка межатомного. В термодинамике фазой называется часть системы, однородная по физическим и химическим свойствам. При определенных условиях (равенство давлений, температур, химических потенциалов) фазы могут находиться в равновесии друг с другом. Состояния равновесия двух фаз изобразятся на диаграмме (р,Т) линией р= f (Т). Три фазы одного и того же вещества могут находиться в равновесии только при единственных значениях температуры и давления, которым на диаграмме (р,Т) соответствует тройная точка. Переход из одной фазы в другую – фазовый переход. Онвсегда связан с качественными изменениями свойств вещества. Различают фазовые переходы двух родов. Фазовый переход I рода (например, плавление, кристаллизация и т. д.) сопровождается поглощением или выделением теплоты и изменением объема, называемой теплотой фазового перехода. Фазовые переходы, не связанные с поглощением или выделением тепла и изменением объема, называютсяфазовыми переходами II рода. Эти переходы характеризуются скачкообразным изменением теплоемкости. Примерами фазовых переходов II рода являются: переход ферромагнитных веществ (железа, никеля) при определенном давлении и температуре в парамагнитное состояние; переход металлов и некоторых сплавов при температуре, близкой к 0 К, в сверхпроводящее состояние; превращение обыкновенного жидкого гелия (гелия I) при Т=2,9К в другую жидкую модификацию (гелий II), обладающую свойствами сверхтекучести.
Для наглядности изображения фазовых превращений используется диаграмма состояния. На рисунке изображена примерная диаграмма состояний некоторого вещества. Линиями АTтр (кривая плавления), ВТтр (кривая сублимации), КТтр (кривая испарения) поле диаграммы делится на три области, соответствующие условиям существования твердой, жидкой и газообразной фаз. Точка Ттр – тройная точка. По фазовой диаграмме легко определить, в каком состоянии находится данное вещество при заданных условиях (р и Т). Точка К на кривой равновесия жидкой и газообразной фаз – критическая точка. Термодинамика дает метод расчета кривой равновесия двух фаз одного и того же вещества. Согласно уравнению Клапейрона-Клаузиуса, производная от равновесного давления по температуре равна:
где q – удельная теплота фазового перехода, Уравнение Клапейрона-Клаузиуса позволяет определить наклоны кривых равновесия. Поскольку q и Т –положительны, наклон задается знаком На диаграмме удобно изображать также процессы изменения состояния вещества. Например, изобарическое (р=const) нагревание вещества, находящемся в твердом состоянии 1 (см. рис.). При температуре, соответствующей точке 2, тело начинает плавиться, при температуре, соответствующей точке 3, – испаряться. При дальнейшем повышении температуры целиком переходит в газообразное состояние. Если же вещество находится в твердом состоянии, то при изобарном нагревании (штриховая прямая 5-6), кристалл превращается в газ минуя жидкую фазу. Кривые плавления и сублимации не могут обрываться, как это имеет место для кривой испарения в критической точке. Кривая плавления уходит в бесконечность, а кривая сублимации идет в точку, где р=0 и Т=0 К.
|


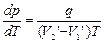
 – изменение удельного объема вещества при переходе его из первой фазы во вторую, Т – температура перехода.
– изменение удельного объема вещества при переходе его из первой фазы во вторую, Т – температура перехода.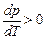 ; следовательно, увеличение давления приводит к повышению температуры плавления (рис. а). Для некоторых же веществ (вода, германий, чугун, висмут и др.) объем жидкой фазы меньше объема твердой фазы, то есть
; следовательно, увеличение давления приводит к повышению температуры плавления (рис. а). Для некоторых же веществ (вода, германий, чугун, висмут и др.) объем жидкой фазы меньше объема твердой фазы, то есть 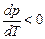 ; следовательно, увеличение давления сопровождается понижением температуры плавления (рис. б).
; следовательно, увеличение давления сопровождается понижением температуры плавления (рис. б).


