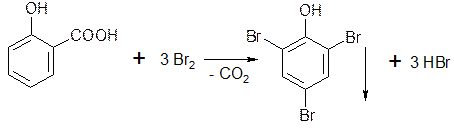Химические свойства.
Фенольный гидроксил – гидроксил, связанный с ароматическим циклом. 1. Кислотно–основные свойства обусловлены наличием в фенольном гидроксиле подвижного атома водорода. Электронная пара гидроксила смещена в сторону ароматического цикла, поэтому кислотные свойства более сильные, чем у спиртов. Так pKa угольной кислоты = 6,35, а pKa фенола = 9,89. Фенолы растворяются в водных растворах щелочей с образованием фенолятов (феноксидов):
Однако кислотный характер фенолов выражен настолько незначительно, что даже такая слабая кислота как угольная, вытесняет фенолы из их солей:
Поэтому фенолы, растворяясь в щелочах, не могут растворяться в карбонатах, т.к. освобождающаяся при этом угольная кислота тотчас же разлагает фенолят:
Это свойство фенолов отличает их от карбоновых кислот. При повышении температуры реакция идет в прямом направлении. Феноляты щелочных металлов, как соли сильных оснований и слабых кислот, частично гидролизованы в водных растворах, поэтому растворы фенолятов обладают щелочной реакцией.
2. Реакция этерификации (аналогично спиртовому гидроксилу). Образование простых эфиров – реакция фенолятов и галоидных алкилов (или алкилсульфатов).
C6H5ONa+JCH3®C6H5OCH3+NaJ
3. Окислительно – восстановительные свойства. Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями, при этом образуются окрашенные соединения хиноидной структуры.
Примером реакции окисления является образование индофенолового красителя: образующийся хинон при взаимодействии с NH3 превращается в хинонимин, который взаимодействует с не прореагировавшим фенолом. В присутствии аммиака образуется индофенол, окрашенный в синий цвет.
хинонимин индофенол n- бензохинонимин
Разновидностью индофеноловой реакции является нитрозореакция Либермана, которая характерна для тех фенолов, у которых нет заместителей в орто- и пара-положениях. При действии нитрита натрия в кислой среде образуется n -нитрозофенол, изомеризующийся в монооксим n -бензохинона, который затем, реагируя с избытком фенола в кислой среде, дает индофенол.
Наблюдается окрашивание, изменяющееся при добавлении раствора щелочи: фенол – темно-зеленое, переходящее в вишнево-красное; тимол – сине-зеленое, переходящее в фиолетовое; резорцин – фиолетово-черное, переходящее в фиолетовое; гексэстрол (синэстрол) – красно-фиолетовое, переходящее в вишневое.
4. Реакция комплексообразования с ионами железа. В зависимости от количества фенольных гидроксилов, наличия в молекуле других функциональных групп, их взаимного расположения, pH среды, температуры, образуются комплексные соединения различного состава и окраски (исключение – тимол).
4.1.
4.2.
4.3.
Комплексы окрашены: фенол – синий цвет; резорцин – сине-фиолетовый цвет; кислота салициловая – сине-фиолетовый или красно-фиолетовый цвет; осалмид (оксафенамид) – красно-фиолетовый цвет; натрия пара-аминосалицилат – красно-фиолетовый цвет; хинозол – синевато-зеленый цвет. Реакция является фармакопейной для большинства фенольных соединений.
5. Реакции электрофильного замещения – SE атома водорода в ароматическом кольце (бромирование, конденсация с альдегидами, сочетание с солями диазония, нитрование, нитрозирование, йодирование и др.). Способность фенолов вступать в реакции электрофильного замещения объясняется взаимодействием неподеленной электронной пары атома кислорода с π-электронами бензольного кольца. Электронная плотность смещается в сторону ароматического кольца. Наибольший избыток электронной плотности наблюдается у атомов углерода в о- и n- положениях по отношению к фенольному гидроксилу (ориентанту I рода).
5.1. Реакция галогенирования (бромирование и йодирование). 5.1.1. При взаимодействии с бромной водой образуются белые или желтые осадки бромпроизводных.
При избытке брома происходит окисление:
Реакция бромирования фенолов зависит от природы и положения заместителей. Аналогично происходит йодирование, например:
5.1.2. При наличии заместителей в о- и n- положениях ароматического кольца в реакцию вступают незамещенные атомы водорода ароматического кольца.
5.1.3. Если в о- и n- положениях по отношению к фенольному гидроксилу находится карбоксильная группа, то при действии избытка брома происходит декарбоксилирование:
5.1.4. Если соединение содержит два фенольных гидроксила в м- положении, то при действии брома образуются трибромпроизводные (согласованная ориентация):
5.1.5. Если две гидроксильные группы расположены по отношению друг к другу в о- или n- положениях, то реакция бромирования не протекает (несогласованная ориентация)
5.2. Реакции конденсации 5.2.1. С альдегидами. Примером конденсации фенолов с альдегидами является реакция с реактивом Марки. При нагревании фенолов с раствором формальдегида в присутствии концентрированной H2SO4 образуются бесцветные продукты конденсации, при окислении которых получаются интенсивно окрашенные соединения хиноидной структуры. Серная кислота играет в данной реакции роль дегидратирующего, конденсирующего средства и окислителя.
5.2.2. Реакция фенолов с хлороформом (CHCl3) с образованием ауриновых красителей. При нагревании фенолов с CHCl3 в щелочной среде образуются аурины – трифенилметановые красители:
Аурины окрашены: фенол – желтый цвет; тимол – желтый цвет, переходящий в фиолетовый; резорцин – красно-фиолетовый цвет.
5.2.3. С ангидридами кислот.
А. Реакция образования флуоресцеина (конденсация резорцина с фталевым ангидридом).
 
Б. Реакция образования фенолфталеина (конденсация фенола с фталевым ангидридом).
При большом избытке щелочи образуется трехзамещенная натриевая соль. Конденсация тимола с фталевым ангидридом идет аналогично реакции образования фенолфталеина, образуется тимолфталеин, имеющий синее окрашивание в щелочной среде.
5.3. Реакция нитрования Фенолы вступают в реакцию с разбавленной азотной кислотой (HNO3) и образуют орто- и пара-нитропроизводные. Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциированной соли.
5.4. Реакция азосочетания фенолов с солью диазония в щелочной среде. При взаимодействии фенолов с солью диазония при pH 9-10 образуются азокрасители, окрашенные в желто-оранжевый или красный цвет. Реакция азосочетания протекает в орто- и пара-положениях по отношению к фенольному гидроксилу. В качестве диазореактива обычно применяют диазотированную сульфаниловую кислоту.
В случае фенола
|




 Сложные эфиры образуются при взаимодействии фенолятов натрия с ангидридами (или хлорангидридами кислот).
Сложные эфиры образуются при взаимодействии фенолятов натрия с ангидридами (или хлорангидридами кислот).