
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Екологічне нормування та стандартизація.
Дата добавления: 2015-08-17; просмотров: 778
|
|
Серная кислота. При обычных условиях концентрированная серная кислота представляет собой тяжёлую маслянистую жидкость без цвета и запаха, с кислым «медным» вкусом. Смешивается с водой в любых соотношениях с выделением тепла. Серная кислота малолетуча, однако при температуре выше 50 0С способна к образованию паров серного ангидрида, обладающего большей токсичностью, чем сама кислота.
В промышленности выпускается в виде моногидрата - 98% раствор серной кислоты; олеума - 20% раствора серного ангидрида SO3 в серной кислоте; неочищенной серной кислоты (купоросное масло) - 93-97% раствор серной кислоты.
Применяется серная кислота практически в любой области промышленности: в производстве минеральных удобрений; как электролит в свинцовых аккумуляторах; для получения различных минеральных кислот и солей; в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ; в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности; в пищевой промышленности (пищевая добавка Е 513), в промышленном органическом синтезе (в реакциях: дегидратации, гидратации, сульфирования, алкилирования и др.), для восстановления смол в фильтрах на производстве дистилированной воды.
Основными путями поступления серной кислоты в организм являются пероральные, ингаляционные и перкутанные. Смертельной дозой принято считать 5 – 10 г.
При ингаляционных отравлениях наблюдается затрудненное дыхание, которое сопровождается кашлем, охриплостью, возможно развитие ларингита, бронхита или трахеита. При вдыхании больших концентраций развивается отек гортани, легких, возможно развитие асфиксии и шока. Скрытый период отравления серной кислотой может составлять до 90 суток.
При попадании серной кислоты на кожные покровы, она быстро проникает вглубь тканей, образуя сначала белые, а, с истечением времени, коричнево-черные струпья.
При патологоанатомической экспертизе пероральных отравлений наблюдаются следы химического ожога вокруг рта (бурые полосы и пятна), Слизистые оболочки рта, глотки, пищевода окрашены в серо-бурый цвет, слизистая желудка – серовато-красная.
Качественный и количественный анализ на наличие серной кислоты.
При исследовании диализата на наличие серной кислоты ее перегоняют над медными опилками и собирают отгон в приемник, содержащий раствор йода в йодиде калия.
В колбе проходит окислительно-восстановительная реакция с образованием сернистой кислоты, а затем ее разложения до оксида серы (II).
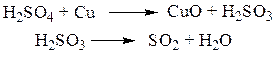
Оксид серы с парами воды, попадая в приемник, взаимодействует с раствором йода с образованием серной кислоты.
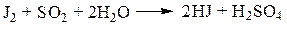
При простой перегонке из-за постоянного присутствия хлоридов извлекаемых из биообъекта, они вступают в реакцию со свободной серной кислотой, с образованием хлористого водорода.

Образующуюся в результате перегонки серную кислоту обнаруживают по реакциям:
ü Реакция образования сульфата бария. Появление белого осадка при добавлении хлорида бария свидетельствует о наличии сульфат-ионов, но не доказывает присутствия свободной серной кислоты.
ü Реакция получения сульфата свинца. Выпадение белого осадка, нерастворимого в азотной кислоте, но растворимого в растворах щелочей и растворе ацетата аммония.
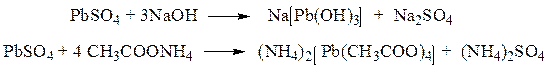
ü Реакция с родизонатом бария. Реакция основана на том, что натрия родизонат с солями бария образует бария родизонат, имеющий красную окраску. От добавления серной кислоты или сульфат-ионов бария родизонат разлагается, образуется белый осадок бария сульфата, а красная окраска исчезает.
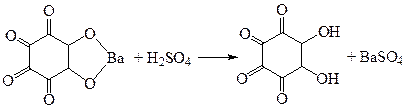
Реакция специфична для сульфат-иона. Исследование на наличие свободной серной кислоты.
Количественное определение серной кислоты проводят методом алкалиметрии. В качестве титранта используют 0,1 М раствор гидроксида натрия (индикатор метиловый оранжевый).
Хлористоводородная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.) едкая жидкость с резким запахом, содержащая 35 – 38% хлористого водорода. На воздухе легко испаряется, «дымит» из-за образования хлористого водорода с парами воды капелек тумана. Смешивается с водой в любых соотношениях.
В промышленности выпускают «аккумуляторную» хлористоводородную кислоту, содержащую около 37% хлористого водорода и концентрированную хлористоводородную кислоту, содержащую примерно 25% хлористого водорода.
Применяется в химическом синтезе, гидрометаллургии и гальванопластике (для обработки руд, травления металлов), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с ПАВ используется для очистки керамических и металлических изделий от загрязнений и дезинфекции. В пищевой промышленности зарегистрирована в качестве регулятора кислотности и пищевой добавки E 507. Хлористоводородная кислота является естественной составной частью желудочного сока человека. Растворы соляной кислоты, 0,3 - 0,5%, обычно в смеси с ферментом пепсином, назначают внутрь больным с недостаточной кислотностью.
Основным путем поступления хлористоводородной кислоты является ингаляционный, реже перкутанный и пероральный. Смертельной дозой считается 10 – 15 г хлористоводородной кислоты.
При вдыхании хлористого водорода наблюдается раздражение верхних дыхательных путей и легких, проявляющееся охриплостью, кашлем, болью в груди. В тяжелых случаях летальный исход наступает от асфиксии в результате отека гортани или спазма голосовой щели через 3 – 4 часа.
При перкутанном и пероральном отравлениях симптомы аналогичны симптомам отравления серной кислотой, однако выражены в меньшей степени. На коже наблюдается серозное воспаление с пузырями, пораженные участки имеют серо-белесоватый цвет, ожоги незначительны. При попадании на слизистую оболочку глаза вызывает конъюнктивит, химический ожог, помутнение роговицы.
При паталогоанатомическом вскрытии наблюдается сероватый или черный цвет слизистых оболочек полости рта, пищевода, желудка и верхнего отдела кишечника. Содержимое желудка представляет собой бурую массу. Печень, почки и сердце подвержено жировой дистрофии. Сердечная мышца дряблая и имеет желтоватый цвет.
Качественный и количественный анализ на наличие хлористоводородной кислоты.
Водное извлечение из биологического материала или диализат, первоначально исследуют на наличие хлорид-ионов. Образование обильного белого осадка с нитратом серебра указывает на необходимость проведения дальнейшего исследования на свободную хлористоводородную кислоту.
Вследствие возможности образования хлористоводородной кислоты из хлоридов при наличии свободной серной кислоты сначала проводят исследование на серную кислоту, а затем на хлористоводородную.
При исследовании диализата на наличие хлористоводородной кислоты, ее, как и соляную кислоту, получают путем перегонки диализата на песчаной бане. Первоначально из колбы в приемник отгоняется вода, а при достижении хлористого водорода 10% концентрации, он начинает перегоняться в приемник и растворяется в присутствующей воде. По возможности перегонку проводят до выпаривания всей жидкости из колбы.
Дистиллят исследуют на наличие хлористого водорода реакциями:
ü Реакция с нитратом серебра. Появление белого осадка, растворимого в растворе аммиака и образующегося снова при добавлении азотной кислоты, свидетельствует о наличии хлорид-ионов.
ü Реакция выделения йода. При добавлении к дистилляту калия хлората при небольшом нагревании, выделяется свободный хлор, который обнаруживают по посинению йодкрахмальной бумаги.
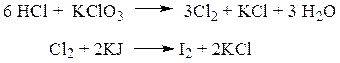
Количественное определение.
Количественное определение хлористого водорода важно, чтобы судить о том, имеется ли в данном случае (например, в рвотных массах) введенная кислота, а не хлористоводородная кислота желудочного сока (0,1—0,2%), которая обычно в содержимом желудка трупа уже нейтрализована.
Определенную часть водного извлечения подвергают перегонке, выпаривая содержимое колбы, как описано выше, досуха. В дистилляте определяют количество хлористого водорода титрованием по Фольгарду или весовым путем, взвешивая серебра хлорид.
Метод Фольгарда не применим к количественном определению хлористоводородной кислоты, если биологический материал подвержен гниению Образующийся сероводород вступает в реакцию с нитратом серебра с образованием осадка сульфида серебра (AgS) и искажает результаты анализа. Поэтому для количественного определения хлористоводородной кислоты в несвежем биологическом материале используют метод гравиметрии.
К раствору добавляется избыток нитрата серебра, образующиеся осадки хлорида и сульфида серебра отфильтровывают и обрабатывают 10% раствором аммиака для растворения хлорида серебра. Аммиачный раствор подкисляют азотной кислотой, и выделившийся осадок хлорида серебра отфильтровывают, высушивают и взвешивают.
Азотная кислота. Бесцветная прозрачная жидкость. Смешивается с водой в любых соотношениях. В открытом виде азотная кислота выделяет тяжелее пары, образующие белый дым. Негорюча, но обладает способностью воспламенять все горючие вещества. Способна взрываться в присутствии растительных и минеральных масел, спирта.
В промышленности выпускается в виде 50 – 60% и 96 – 98% растворов.
Промышленное применение азотной кислоты: в производстве минеральных удобрений; в военной промышленности (в производстве взрывчатых веществ, как окислитель ракетного топлива, в синтезе различных веществ, в том числе отравляющих); для травления печатных форм; в производстве красителей и лекарств (нитроглицерин); в ювелирном деле (основной способ определения золота в золотом сплаве).
Как и у предыдущих кислот, основными путями поступления азотной кислоты являются ингаляционный, перкутанный и пероральный. Смертельной дозой считается 8 – 10 г азотной кислоты.
Раздражение верхних дыхательных путей и легочной ткани ведет к развитию токсического отека легких. Скрытый период составляет от 3 до 6 ч. При ингаляционных отравлениях наблюдаются синюшность слизистых оболочек век и губ, в трахее и бронхах скапливается большое количество мелкопузырчатой пены, легкие увеличены в объеме, на разрезе цвет легких синюшно-красный с большим скоплением пены. Внутренние органы полнокровны, наблюдается отек мягкой мозговой оболочки и головного мозга.
При попадании на кожу ткани приобретают желтый цвет за счет продуктов разложения и нитрования. При приеме внутрь отравление начинается с резких болей во рту, глотке, пищеводе, желудке. Рвота бурыми массами с обрывками слизистой оболочки. Летальный исход наступает вследствие шока или коллапса.
При паталогоанатомическом вскрытии содержимое желудка имеет запах оксидов азота, в окружности и слизистой оболочки рта, слизистой пищеварительного тракта наблюдается желтоватая окраска. Сердечная мышца и печень серовато-красного цвета с бурым оттенком, дряблые.
Качественный и количественный анализ на наличие азотной кислоты.
Для обнаружения азотной кислоты перегонку диализата проводят, как и в случае с серной кислотой, над медными опилками, а в приемник, для улавливания образующегося в колбе оксида азота (IV), помещают воду. При взаимодействии азотной кислоты с медными опилками образуется оксид азота (II), который окисляется до оксида азота (IV), реагирующего с водой, в результате чего образуется смесь азотной и азотистой кислот.
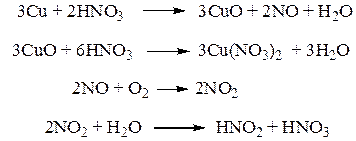
Обнаружение образующихся азотной и азотистой кислот проводят по реакциям:
ü Реакция с дифениламином. Реакция основана на окислении дифениламина азотной кислотой, при этом вначале образуется бесцветный дифенилбензидин, который при дальнейшем окислении превращается в соединение синего цвета. Реакция является неспецифичной. Такое же окрашивание дают соли азотной и азотистой кислот, а также другие окислители.
ü Реакция с бруцином. Появление красного окрашивания свидетельствует о наличии азотной кислоты.
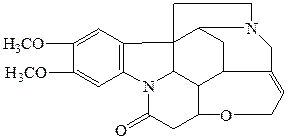 БРУЦИН
БРУЦИН
ü Реакция с белком на азотную кислоту (ксантанпротеиновая проба). Свободная азотная кислота при достаточной концентрации способна фиксироваться белками и окрашивать их в желтый цвет, переходящий в оранжевый от добавления аммиака. Шерстяные и шелковые нити будут изменять свою окраску в результате данной реакции в отличие от хлопчатобумажных нитей, которые остаются белыми.
Подобную окраску (пожелтение нитей) может давать и пикриновая кислота, однако и окрашивание раствора диализата тоже будет желтым.
Реакция на азотистую кислоту. Зеленое окрашивание при добавлении раствора феназона в присутствии серной кислоты, свидетельствует о наличии азотистой кислоты в диализате.
Количественное определение азотной кислоты проводят методом нейтрализации. В качестве титранта используют 0,1М раствор натрия гидроксида, индикатор – фенолфталеин.
| <== предыдущая лекция | | | следующая лекция ==> |
| Екологічний моніторинг. | | | Екологічний контроль. |