
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Екологічний контроль.
Дата добавления: 2015-08-17; просмотров: 803
|
|
К едким щелочам относят натрия гидроксид (каустическая сода, NаОН), калия гидроксид (КОН) и кальция гидроксид Са(ОН)2. Слабое основание – раствор аммиака (NН4ОН).
Гидроксид натрия(каустическая сода, каустик, едкий натр, едкая щёлочь). Белое твёрдое кристаллическое вещество. На воздухе расплывается, так как притягивает влагу. Хорошо растворяется в воде с большим выделением теплоты, образуя растворы мылкие на ощупь. Растворяется в спирте и глицерине.
Гидроксид натрия применяется в большинстве отраслей промышленности и для бытовых нужд: в целлюлозно-бумажной промышленности; для омыления жиров при производстве мыла, шампуней и других моющих средств; в химических отраслях промышленности (для нейтрализации кислот и кислотных окислов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке для производства масел); в качестве агента для растворения засоров канализационных труб; в гражданской обороне для дегазации и нейтрализации отравляющих веществ; для очистки выдыхаемого воздуха от углекислого газа; при приготовлении пищи (для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий, в качестве пищевой добавки E-524.
Пути поступления в организм: пероральный, ингаляционный (в виде пыли). Особенно выражено действие при непосредственном контакте с кожей или слизистыми. Развивается резко выраженное раздражающее и прижигающее действие, глубокие некрозы из-за образования рыхлых растворимых белковых альбуминатов. Смертельной дозой принято считать 10 – 20 г гидроксида натрия.
При попадании на кожу или слизистые типичен глубокий ожог с образованием мягких струпьев и последующим их рубцеванием. При ингаляционном поражении возникает острый воспалительный процесс дыхательных путей; возможна пневмония. При попадании гидроксида натрия внутрь (перорально) наблюдается острое воспаление, мелкие язвы, ожоги слизистых оболочек губ, рта, пищевода и желудка. Отравление сопровождается сильной жаждой, слюнотечением, кровавой рвотой, при тяжелых случаях развивается внутреннее кровотечение. Попадание на слизистую глаза чревато сильными ожогами, вплоть до появления слепоты.
Качественный и количественный анализ на наличие гидроксида натрия.
Обнаружение гидроксида натрия проводят по катиону Na+.
ü Реакция с гидроксистибиатом калия. В уксуснокислой среде при добавлении к диализату раствора гидроксистибиата калия появляется белый кристаллический осадок.
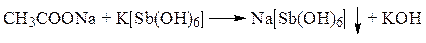
Переоткрытие гидроксида натрия возможно из-за образования в кислой среде метосурьмяной кислоты HSbO3, которая будет выпадать в осадок.
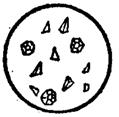
ü Реакция с цинк-уранилацетатом. При наличии ионов натрия в нейтральных и уксуснокислых средах цинк-уранилацетат образует кристаллический осадок зеленовато-желтого цвета. Кристаллы имеют вид октаэдров или тетраэдров.
| 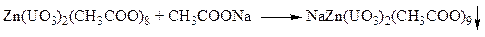
|
Количественное определение гидроксида натрия проводят методом ацидиметрии, используя в качестве титранта 0,1М раствор хлористоводородной кислоты, индикатор – фенолфталеин.
Гидроксид калия (едкое кали, каустический поташ). Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы имеют сильнощелочную реакцию.
Применение в промышленности: в пищевой промышленности (пищевая добавка E525), для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах, в производстве жидких мыл, для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки, электролит в щелочных (алкалиновых) батарейках.
Пути поступления в организм и симптомы отравлений сходны с гидроксидом натрия. Многие реакции на организм выражены сильнее, чем у гидроксида натрия. Смертельной дозой считается 10 – 20 г гидроксида калия.
Качественный и количественный анализ на наличие гидроксида калия.
Выраженная щелочная реакция среды диализатов, отсутствие карбонатов и присутствие ионов калия указывают на наличие калия гидроксида в материале.
Для обнаружения ионов калия в диализатах применяют реакции:
ü Реакция с гидротартратом натрия (NaHC4H4O6). Выпадение белого осадка свидетельствует о присутствии К+.
ü Реакция с кобальтнитритом натрия (Na3[Co(NO2)6]. При наличии ионов калия выпадает желтый кристаллический осадок K2Nа[Сo(NO2)6].
Эти реактивы дают осадки с ионами калия в нейтральных или слабокислых растворах, поэтому, диализаты, имеющие щелочную реакцию, до начала исследования нейтрализуют или доводят до слабокислой реакции (рН=3-4) раствором уксусной кислоты.
Количественное определение гидроксида калия проводят методом ацидиметрии, используя в качестве титранта 0,1М раствор хлористоводородной кислоты, индикатор – фенолфталеин.
Аммиак – едкий бесцветный газ с резким запахом. Обладает высокой летучестью. Очень летуч. При растворении аммиака в воде образуется гидроксид аммония.Аммиак водный (аммония гидроксид, аммиачная вода, едкий аммоний, едкий аммиак). Летучая жидкость с резким специфическим запахом. Токсичность в воздухе резко возрастает при повышении температуры и влажности.
Промышленно выпускается 25%-й раствор аммиака. Насыщенный раствор содержит 33% аммиака, а нашатырный спирт – 10%. Промышленное применение: в пищевой промышленности (пищевая добавка E 527); в качестве удобрения.
Основной путь поступления аммиака – ингаляционный. Смертельной дозой считается 10 – 15 мл 33% раствора или 25 – 50 мл 10% раствора.
При больших концентрациях в воздухе наблюдается обильное слезотечение, боль в глазах, ожог конъюнктивы и роговицы, потеря зрения. Со стороны дыхательных путей – приступы кашля, резкий отек языка, ожог слизистых оболочек верхних дыхательных путей с некрозом, отек гортани, бронхит, бронхоспазм. При очень высоких концентрациях наступает паралич ЦНС и быстрая смерть при явлениях асфиксии. Смерть наступает в течение 10 – 15 минут.
При паталогоанатомическом вскрытии наблюдаются ярко-красные оболочки рта, глотки, пищевода, желудка, отек легких, изменения в почках (нефроз и некроз извитых канальцев), кровоизлияние в головной мозг, запах аммиака от внутренних органов.
Качественный и количественный анализ на наличие гидроксида аммония.
Анализ на аммиак проводиться, если предварительные испытания указали на возможное его присутствие.
Предварительные испытания на аммиак проводят с тремя индикаторными бумажками: красной лакмусовой, смоченной раствором сульфата меди и смоченной раствором свинца ацетата. Посинение красной лакмусовой бумажки и бумажки смоченной раствором меди сульфата указывает на наличие аммиака.
Почернение «свинцовой» бумажки указывает на наличие сероводорода и, следовательно, на процесс гниения. В этом случае исследование на наличие аммиака является нецелесообразным. Образование аммиака может происходить также при наличии щелочей (NаОН, КОН), выделяющих аммиак из его солей и белковых веществ.
Реакция с реактивом Несслера. Желто-бурое или оранжево-коричневое окрашивание выпавшего осадка дийододимеркураммония свидетельствует о наличии аммиака в диализате. Реакция не является специфичной, поскольку многие ионы могут давать осадки такого цвета в щелочной среде в присутствии иодид-ионов.
Количественное определение гидроксида аммония проводят методом ацидиметрии, используя в качестве титранта 0,1М раствор хлористоводородной кислоты, индикатор – метиловый оранжевый.
| <== предыдущая лекция | | | следующая лекция ==> |
| Екологічне нормування та стандартизація. | | | Правове регулювання оцінки впливу на довкілля. Співвідношення ОВНС і екологічної експертизи |