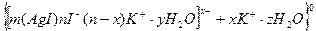Коллоидное состояние вещества
Частицы дисперсных размеров получают либо измельчением крупных тел (диспергированием), либо объединением (конденсацией) атомов, молекул, ионов. Образование систем высокой дисперсности по конденсационному механизму возможно, если возникает большое число зародышей новой, термодинамически более стабильной фазы, с другой стороны, скорость роста этих зародышей лежит в области умеренных значений. Процессы, приводящие к появлению коллоидной системы, можно разделить на две группы: химические, то естьпротекание химических реакций, приводящих к возникновению высокой концентрации слаборастворимого соединения; и физические, такие как изменение давление, температура, растворителя и т.д. Любая химическая реакция, приводящая к образованию нерастворимого продукта, может быть использована для получения коллоидной системы. К образованию коллоидных растворов – золей приводят различные химические реакции: окисления-восстановления, гидролиза, обмена и т.д. Любой золь состоит из мицелл и интермицеллярной жидкости. Под интермицеллярной жидкостью понимают дисперсионную среду, содержащую растворенные электролиты и неэлектролиты. Мицеллы – это электрически нейтральные структурные единицы, находящиеся в растворе и участвующие в броуновском движении. Они представляют собой сложное структурное образование, состоящее из агрегата (ядра), потенциалообразующих ионов и противоионов. Коллоидная частица, или золь, включает в себя ядро, адсорбированные ионы, противоионы и растворитель. Ядро состоит из электронейтрального агрегата частиц малорастворимых соединений, на которых адсорбируются ионы элементов, входящих в состав ядра. При выборе потенциалообразующих ионов пользуются эмпирическим правилом Фаянса – Панета –Пескова: на твердой поверхности агрегата в первую очередь адсорбируются ионы, которые · входят в состав агрегата; · способны достраивать кристаллическую решетку агрегата; · образуют малорастворимое соединение с ионами агрегата; · изоморфны с ионами агрегата. Поверхность ядра приобретает определенный заряд благодаря избирательной адсорбции ионов определенного знака, называемых потенциалообразующими ионами. К этим ионам электростатически притягивается эквивалентное количество ионов противоположного знака, называемых противоионами. Часть противоионов прочно связана с ядром в составе его адсорбционного слоя, образуя гранулу, или коллоидную частицу; остальные входят в диффузный слой за границей скольжения. Коллоидная частица содержит ещё молекулы растворителя. Адсорбированные ионы и противоионы с растворителем образуют адсорбционный слой. Суммарно заряд частицы равен разности зарядов адсорбированных ионов и противоионов. Знак заряда коллоидной частицы определяется знаком заряда потенциалообразующих ионов. Вокруг частиц находится диффузный слой ионов, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.
В качестве примера приведем золь йодида серебра:
а) при избытке в растворе нитрата серебра
двойной электрический слой
1 противоионы
ядро
коллоидная частица
мицелла
где 1- потенциалообразующие ионы
б) при избытке в растворе йодида калия
двойной электрический слой
1 противоионы
ядро
коллоидная частица
мицелла
где 1- потенциалообразующие ионы
Электролит, ионы которого образуют двойной электрический слой (ДЭС), называется электролитом-стабилизатором, поскольку он стабилизирует золь, придавая ему агрегативную устойчивость.
Пример 30. Золь йодида серебра получен методом химической конденсациипри избытке нитрата серебра. К какому электроду будет двигаться частица при электрофорезе? Напишите формулу мицеллы золя. Решение. Рассмотрим процесс образования мицеллы золя йодида серебра при избытке нитрата серебра: AgNO3(изб) + KI → AgJ↓ + KNO3 Так как нитрат серебра взят в избытке, следовательно, раствор AgNO3 будет являться электролитом-стабилизатором, ионы которого образуют ДЭС: AgNO3 → Ag+ + NO Согласно правилу Фаянса – Панета – Пескова, ионы серебра Ag+ будут являться потенциалообразующими ионами, а ионы NO Формулу мицеллы можно записать в следующем виде: {[(mAgI)∙ nAg+∙ (n-x)NO Так как коллоидная частица заряжена положительно, то при электрофорезе она будет двигаться к отрицательно заряженному электроду (катоду).
Пример 31. Для получения золя хлорида серебра смешали 15 см3 0, 025 н раствора хлорида калия с 85 см3 0, 005 н раствора нитрата серебра. Написать формулу мицеллы полученного золя. Решение. Находим число мг-экв KCl: 15см3 ∙ 0, 025 мг-экв/см3= 0, 375мг-экв Определяем количество мг-экв AgNO3: 85∙ 0, 005 мг-экв/см3= 0, 425 мг-экв Очевидно, что в растворе имеется избыток AgNO3. ядром коллоидных частиц золя AgCl будут адсорбироваться преимущественно ионы Ag+ и частично ионы NO
Формула мицеллы хлорида серебра будет
ядро
частица
мицелла
Вариант 1 19. Какой объём 0, 005н раствора нитрата серебра надо прибавить к 20см3 0, 015н раствора иодида калия, чтобы получить положительный золь иодида серебра? Написать формулу мицеллы. Вариант 2 19. Золь бромида серебра получен смешиванием 25см3 0, 008н раствора бромида калия и 18см3 0, 0096н раствора нитрата серебра. Определить знак заряда частиц золя и написать формулу его мицеллы
Вариант 3 19. Золь иодида серебра получен при постепенном добавлении к 20см3 0, 01н раствора иодида калия 15см3 0, 2%-ного раствора нитрата серебра. Написать формулу мицеллы образовавшегося золя. Плотность раствора нитрата серебра равна единице.
Вариант 4 19. Золь хлорида серебра получен смешиванием равных объёмов 0, 0095М хлорида калия и 0, 012М нитрата серебра. Написать формулу мицеллы.
Вариант 5 19. Золь сульфата бария получен сливанием равных объёмов растворов нитрата бария и серной кислоты. Одинаковы ли исходные концентрации электролитов, если при электрофорезе частица перемещается к аноду? Напишите формулу мицеллы золя BsSO4..
Вариант 6 19. Напишите формулы мицелл золей: Al(OH)3, стабилизированного AlCl3; SiO2, стабилизированного H2SiO3. К каким электродам будут двигаться коллоидные частицы каждого из указанных золей при электрофорезе?
Вариант 7 19. Для получения золя AgCl смешали 10 мл 0, 02 М KCl и 100 мл 0, 05 М AgNO3. Напишите формулу мицеллы полученного золя. К какому электроду будет двигаться частица при электрофорезе? Вариант 8 19. Золь хлорида серебра получен смешиванием равных объёмов 0, 0095 М хлорида калия и 0, 012 М нитрата серебра. Напишите формулу мицеллы.
Вариант 9 19. Золь гидроксида алюминия получен сливанием равных объёмов растворов хлорида алюминия и гидкроксида натрия. Одинаковы ли исходные концентрации электролитов, если при электрофорезе частица перемещается к катоду? Напишите формулу мицеллы золя Al(OH)3. Вариант 10 19. Напишите формулу мицеллы гидрозоля AgBr, полученного при сливании разбавленного раствора AgNO3 с избытком КBr. Как изменится строение мицеллы, если гидрозоль AgBr получать при сливании сильно разбавленного раствора КBr с избытком AgNO3?
|







 плотный слой диффузный слой
плотный слой диффузный слой

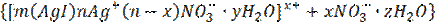 0
0