СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ Взаимодействие водного раствора тиосульфата натрия с серной кислотой протекает по уравнениям: Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3, H2S2O3 = SO2 + S + H2O. Нерастворимая в воде сера выделяется в виде мути. Промежуток времени между началом реакции и ее видимым результатом (появлением мути) связан со скоростью реакции: чем больше скорость (v), тем меньше время (t). Для проведения опыта необходимы три бюретки, заполненные: 1) раствором тиосульфата натрия Na2S2O3 ( 2) раствором серной кислоты H2SO4; 3) водой. Три чистые пробирки нумеруем: «1», «2», «3». В первую пробирку из бюретки наливаем 6 мл раствора Na2S2O3. Во вторую пробирку – 4 мл раствора Na2S2O3 и 2 мл H2O из бюретки. В третью пробирку наливаем 2 мл раствора Na2S2O3 и 4 мл H2O. Три другие чистые пробирки помечаем буквой «к» (кислота). В каждую из этих пробирок наливаем из бюретки по 2 мл раствора H2SO4. В первую пробирку с тиосульфатом натрия вливаем из пробирки «к» отмеренное количество серной кислоты и, быстро взболтав, включаем секундомер. Измеряем время до момента появления мути, полученный результат записываем в таблицу 2. Аналогичные опыты проделываем с растворами в других пробирках.
Таблица 2 – Результаты эксперимента
На миллиметровке начертите график зависимости относительной скорости реакции от концентрации реагента, рис.34.
Рисунок 34 – график зависимости относительной скорости реакции от концентрации реагента
Сделайте вывод о зависимости скорости реакции от концентрации реагентов. Опыт 2. Зависимость скорости реакции от температуры Влияние температуры на скорость реакции можно также проследить по времени помутнения подкисленного раствора тиосульфата натрия. Наливаем в одну пробирку 4 мл раствора тиосульфата натрия, а в другую – 4 мл раствора серной кислоты. В стакан объемом 500 мл наливаем до половины воду комнатной температуры. Обе пробирки помещаем в стакан с водой. Через 4-5 минут измеряем температуру воды в стакане. Выливаем содержание одной пробирки в другую, перемешиваем полученную смесь, ставим пробирку в стакан и включаем секундомер. Измеряем время до момента появления мути, полученный результат записываем в таблицу. В две другие пробирки наливаем 4 мл раствора Na2S2O3 и 4 мл раствора H2SO4. В стакан добавляем горячую воду, чтобы температура воды в стакане повысилась на 10 оС. Пробирки ставим в стакан с водой для термостатирования. Через 5 минут выливаем содержание одной пробирки в другую, перемешиваем полученную смесь, ставим пробирку в стакан и включаем секундомер. Измеряем время до момента появления мути, полученный результат записываем в таблицу. Опыт повторяем, увеличив температуру воды в стакане еще на 10 оС (то есть на 20о выше комнатной). Полученные результаты записываем в таблицу 3.
Таблица 3 – Результаты эксперимента
Рассчитываем, во сколько раз увеличивается скорость реакции при нагревании на каждые 10 оС:
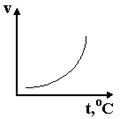
На миллиметровке начертите график зависимости относительной скорости реакции от температуры (для температуры и скорости масштабы удобнее брать разные), рис. 35.
Рисунок 35 – график зависимости относительной скорости реакции от температуры
Сделайте вывод о зависимости скорости реакции от температуры, отметьте, во сколько раз увеличивается скорость реакции при нагревании на каждые 10 оС.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Большинство химических реакций обратимы, т. к. они протекают в прямом и обратном направлениях: Н2 + I2 Û 2 HI. В соответствии с законом действующих масс скорость прямой реакции выражается уравнением: vпр = k1 ´ [H2] ´ [I2]. Скорость обратной реакции vобр = k2 ´ [HI]2, где [H2], [I2], [HI] – равновесные молярные концентрации H2, I2 и HI соответственно. В ходе процесса скорость прямой реакции уменьшается, а скорость обратной – увеличивается до тех пор, пока vпр = vобр. В системе наступает равновесие. Установившееся равновесие является динамическим, то есть прямая и обратная реакции не прекращаются, а идут с одинаковыми скоростями. Поскольку при равновесии скорости прямой и обратной реакции равны, vпр= vобр, то и k1 ´ [H2] ´ [I2] = k2[НI]2. Разделим переменные и постоянные величины:
Частное от деления констант скоростей прямой (k1) и обратной (k2) реакций является величиной постоянной, называется константой химического равновесия и обозначается Кравн .
Для выражения состояния равновесия при взаимодействии между газообразными веществами часто вместо концентраций используют равновесные парциальные давления реагентов
Константа равновесия, выражаемая через равновесные концентрации реагентов (Кс) и константа равновесия, выражаемая через их парциальные давления (Кр), связаны уравнением Кр = Кс ´ (RT)Dn, где Dn – изменение количества вещества газов во время реакции (согласно уравнению Менделеева – Клапейрона p´ V= n´ R´ T или p = c´ R´ T, где с – молярная концентрация). Для реакций, протекающих без изменения количеств газообразных веществ, Кр = Кс. Для реакции СаСО3 (тв) Û СаО (тв) + СО2 (г)↑ К.равн (с) = [СО2] или Кравн(р) = р(СО2), так как концентрации твердых веществ в выражение констант химического равновесия не входят. Для данной реакции Кр=Кс´ R´ T. Для реакции 3Н2 + N2 Û 2 NH3 Dn(газов) = 2 – (3 + 1) = –2
Величина Кравн зависит от природы реагирующих веществ и от температуры, но не зависит от концентраций реагентов и давления в системе (если оно не очень велико). Если К> > 1, в равновесной смеси преобладают продукты взаимодействия (реакция протекает в прямом направлении практически до конца). Если К< < 1, в равновесной смеси преобладают исходные реагенты (реакция в прямом направлении практически не идет). Константа равновесия очень чувствительна к изменению температуры. Для эндотермических процессов (Δ Н0 > 0) повышение температуры приводит к увеличению константы равновесия, для экзотермических (Δ Н0 < 0) – к ее уменьшению. Смещение химического равновесия при изменении внешних условий Под смещением химического равновесия понимают такой процесс, который изменяет соотношение концентраций веществ, участвующих в химической реакции. Направление смещение химического равновесия можно определить с помощью принципа Ле–Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется давление, температура, концентрация реагентов), то в системе происходят процессы, направленные на уменьшение внешнего воздействия. При увеличении температуры равновесие смещается в сторону эндотермической реакции и, наоборот, при уменьшении температуры – в сторону экзотермической. При увеличении давления в реакционной системе равновесие сместится в сторону образования меньшего числа молей газообразных веществ, так как они создают меньшее давление и наоборот. Если реакция протекает без изменения числа молей газообразных веществ, изменение давления на положение равновесия не влияет. При увеличении концентрации исходных веществ равновесие системы смещается вправо, в сторону образования конечных продуктов, а при увеличении концентрации продуктов реакции – влево. При введении катализатора или его замене положение равновесия не меняется, так как катализатор изменяет энергию активации прямой и обратной реакции на одну и ту же величину, то есть скорость прямой и обратной реакции изменится в одинаковое число раз. Равновесие будет достигнуто быстрее, но при тех же равновесных концентрациях. Например, в равновесной химической реакции получения аммиака 3Н2 + N2 Û 2 NH3,
1. При увеличении концентрации водорода или азота равновесие системы сместится в сторону образования аммиака (вправо), концентрация аммиака увеличится (увеличится выход продукта). При уменьшении концентрации аммиака равновесие также сместится вправо. 2. При увеличении давления в системе равновесие сместится вправо, т. к. исходные вещества занимают больший объем, чем продукты (реакция протекает с уменьшением числа молей газообразных веществ). Переход части молекул N2 и Н2 в NH3 несколько уменьшит давление в системе. 3. При увеличении температуры в этой же равновесной системе происходит смещение равновесия влево. Процесс разложения аммиака эндотермический, поэтому смещение равновесия влево снизит температуру реакционной смеси. 4. Введение в систему катализатора – губчатого железа, содержащего оксид калия, приводит к более быстрому достижению равновесия, но при тех же равновесных концентрациях аммиака, азота и водорода.
Лабораторная работа
|

 );
);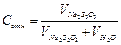


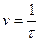
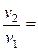

 .
.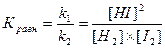 .
. .
. или
или .
.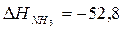 кДж/моль или
кДж/моль или .
.


