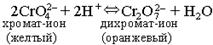ХИМИЧЕСКОЕ РАВНОВЕСИЕ. Опыт 1. Влияние концентрации реагирующих веществ на химическое равновесие
Опыт 1. Влияние концентрации реагирующих веществ на химическое равновесие Для изучения влияния концентрации реагирующих веществ на химическое равновесие удобно воспользоваться реакцией между хлоридом железа (III) и роданидом аммония, которая выражается уравнением: FeCl3 + 3NH4SCN Из веществ этой системы Fe(SCN)3 интенсивно окрашен в красный цвет, разбавленный раствор FeCl3 в бледно-желтый, а растворы NH4SCN и NH4Cl – бесцветны. Поэтому всякое изменение концентрации Fe(SCN)3 сказывается на изменении окраски раствора. Это позволяет наблюдать, в каком направлении сдвигается равновесие при изменении концентрации реагирующих веществ. В стаканчик налейте 20-25 мл дистиллированной воды и прибавьте по одной капле насыщенных растворов FeCl3 и NH4SCN, перемешайте раствор стеклянной палочкой. Полученный раствор налейте в 4 пробирки. Добавьте: – в первую пробирку 1 каплю насыщенного раствора FeCl3, – во вторую пробирку 1 каплю насыщенного раствора NH4SCN, – в третью пробирку щепотку кристаллов NH4Cl. Четвертую пробирку оставьте для сравнения. Сравните интенсивность окраски полученных растворов с цветом раствора в четвертой пробирке. Как изменилась концентрация роданида железа (III) в каждой пробирке? По изменению интенсивности окраски определите направление смещения равновесия. Напишите уравнение обратимой химической реакции и выражение для константы равновесия данной системы. Результаты опыта запишите в таблицу 4. Таблица 4 – Результаты эксперимента
Используя уравнение константы равновесия, поясните, почему изменение концентрации роданида аммония в большей степени влияет на равновесие, чем изменение концентрации хлорида железа (III). Сделайте вывод о влиянии изменения концентраций реагирующих веществ на химическое равновесие (в каком направлении смещается химическое равновесие при увеличении концентрации исходных реагирующих веществ, и в каком направлении – при увеличении концентрации продукта реакции). Опыт 2. Обратимость смещения химического равновесия В растворах, содержащих шестивалентный хром, существует равновесие:
или Cr2O72– + 2ОН– Û 2CrO42– + H2O. В пробирку налейте 3-4 мл раствора хромата калия K2CrO4 и прибавьте несколько капель раствора серной кислоты до изменения окраски. Когда раствор станет оранжевым, добавьте по каплям раствор щелочи КОН до появления желтой окраски. После этого можно опыт повторить: снова прибавить раствор кислоты и получить оранжевую окраску, прибавить раствор щелочи и получить желтую окраску. Опыт 3. Влияние температуры на химическое равновесие При взаимодействии йода с крахмалом образуется вещество сложного состава*, окрашенное в синий цвет. Эта реакция экзотермическая. Равновесие системы можно условно изобразить следующим уравнением: крахмал + йод Û соединение синего цвета + Q Налейте в две пробирки по 2-3 мл раствора крахмала и добавьте по 2 капли йодной воды. Отметьте окраску полученного соединения. Нагрейте одну из пробирок до изменения окраски. ______________________ * Йодокрахмал относится к особому классу соединений, называемых соединениями включения. Соединение образуется путем внедрения молекул йода в полости молекул крахмала. Охладите эту пробирку под струей водопроводной воды. Что произошло с окраской? Сделайте вывод, в каком направлении смещается химическое равновесие системы при нагревании, при охлаждении. РАСТВОРЫ
|

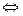 Fe(SCN)3 + 3NH4Cl.
Fe(SCN)3 + 3NH4Cl.