Реакции гидроксильной группы
а) Замещение гидроксильной группы на галогенс образованием галогенопроизводных: C2H5OH + HBr → C2H5Br + H2O б) Дегидратация спиртов. Реакция дегидратации может быть внутримолекулярной и межмолекулярной. При внутримолекулярной дегидратации, которая идет в присутствии катализатора Al2O3 при температуре 380-400 0С, образуются алкены: CH3− СН2− CH2− CH2ОН бутанол-1 бутен-1 Межмолекулярная дегидратация протекает с избытком спирта в присутствии концентрированной серной кислоты (водоотнимающее средство) при температуре 140-150 0С, что приводит к образованию простых эфиров: C2H5OH + HOC2H5 диэтиловый эфир
СH3− CH2− OH
пропанол-2 диметилкетон (ацетон)
+ [O]
Третичные спирты более устойчивы к окислению. Только под действием сильных окислителей они могут окисляться с расщеплением углеродной цепи. ФЕНОЛЫ Фенолы – это органические соединения, в которых гидроксильная группа соединена непосредственно с атомом углерода бензольного кольца. Простейшим представителем фенолов является гидроксибензол или фенол, имеющий одну гидроксильную группу в бензольном кольце:
или С6Н5− ОН
Химические свойства фенолов определяются гидроксильной группой и связанным с ней бензольным кольцом. Кислотные свойства. Под влиянием бензольного кольца полярность связи О− Н возрастает, поэтому подвижность атома водорода гидроксильной группы увеличивается. Этот атом способен к отщеплению в виде протона Н+, вследствие чего фенолы проявляют кислотные свойства и взаимодействуют со щелочными металлами и щелочами: 2 C6H5OH + 2 Na → 2 C6H5ONa + H2 C6H5OH + NaOH → C6H5ONa + H2O Реакции замещения в бензольном кольце. Гидроксильная группа оказывает очень большое влияние на бензольное кольцо, увеличивая его реакционную способность. Поэтому фенол легко вступает в реакции электрофильного замещения (с ориентацией заместителей в о - и п -положения). Например, он легко бромируется бромной водой с образованием 2, 4, 6-трибромфенола, нитруется азотной кислотой с образованием тринитрофенола. Качественная реакция на фенол. Фенол образует с FeCl3 комплексную соль, окрашенную в фиолетовый цвет.
|

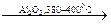
 CH3− СН2− CH=CH2 + H2O
CH3− СН2− CH=CH2 + H2O C2H5− O− C2H5+ H2O
C2H5− O− C2H5+ H2O 3. Дегидрирование спиртов. При пропускании паров спиртов над катализатором при нагревании первичные и вторичные спирты теряют два атома водорода и превращаются соответственно в альдегиды и кетоны:
3. Дегидрирование спиртов. При пропускании паров спиртов над катализатором при нагревании первичные и вторичные спирты теряют два атома водорода и превращаются соответственно в альдегиды и кетоны: + Н2
+ Н2 этанол уксусный альдегид
этанол уксусный альдегид + Н2
+ Н2 + Н2О
+ Н2О



