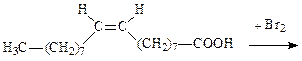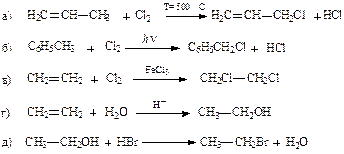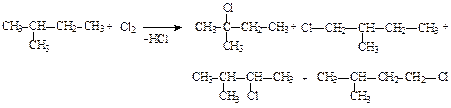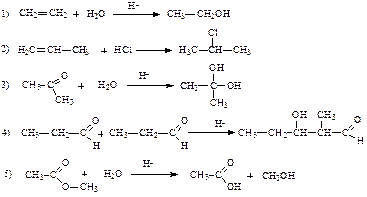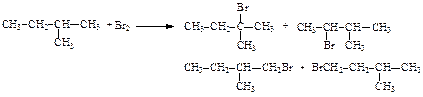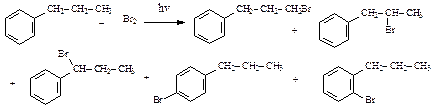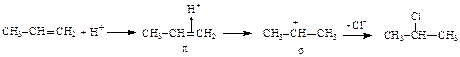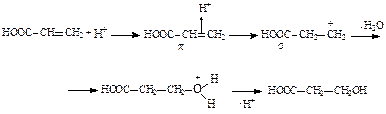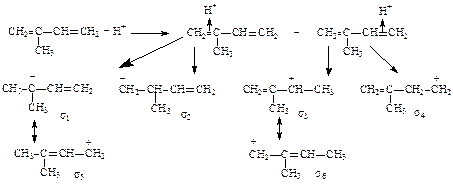Лабораторная работа №2. Бромирование непредельных углеводородов
Ход работы: В пробирку поместите 3-4 капли олеиновой кислоты и растворите ее в тетрахлорметане. Уровень жидкости должен составлять порядка 0, 5 см3. Добавьте в пробирку 4-5 капель 5% раствора брома в тетрахлорметане. В пробирке наблюдается исчезновение красно-бурой окраски брома. Закончите схему реакции бромирования олеиновой кислоты, опишите механизм реакции, в выводе укажите название механизма и отметьте пространственное направление присоединения по двойной связи.
Вывод: __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Тестовые задания к теме: «Реакционная способность углеводородов. Механизмы радикального замещения и электрофильного присоединения» 1. Электрофильные реагенты – это: 1) частицы, являющиеся донором пары электронов 2) частицы, являющиеся акцептором пары электронов 3) катионы 4) атомы благородных газов 5) галогенид-ионы 2. Укажите частицы, являющиеся электрофильными реагентами: 1) Н+ 2) SO3 3) FeBr3 4) Br- 5) СН2=СН2 3. Укажите частицы, являющиеся нуклеофильными реагентами: 1) Н+ 2) Н2О 3) Н- 4) НО- 5) NH3 4. Нуклеофил – это частица, которая: 1) акцептор пары электронов 2) атакует положительно заряженный атом углерода 3) поставляет пару электронов для образования химической связи 4) поставляет свободную орбиталь для образования химической связи 5. Радикальными реагентами являются: 1) катионы, имеющие на внешнем слое только спаренные электроны 2) анионы 3) атомы, имеющие неспаренный электрон 4) атомы, имеющие на внешнем слое октет электронов 5) группировки атомов, имеющие неспаренный электрон 6. Электрофил – это частица: 1) способная к образованию связи с нуклеофилом 2) способная к образованию связи со свободным радикалом 3) акцептор электронной пары 4) донор электронной пары 7. Укажите реакции, идущие по механизму радикального замещения (SR):
1) а, б 2) б, в 3) в, г 4) г, д 5) а, д 8. Статистическая вероятность образования 1-хлорпропана в реакции хлора с пропаном составляет:
1) 20% 2) 25% 3) 50% 4) 75% 5) 80% 9. При хлорировании 2-метилбутана на стадии образования монобромпроизводного в качестве главного продукта образуется:
1) смесь монохлорпроизводных в равных количествах 2) 2-метил-2-хлорбутан 3) 2-метил-1-хлорбутан 4) 2-метил-3-хлорбутан 5) 3-метил-1-хлорбутан 10. Укажите соединение(я), для которых возможно электрофильное присоединение: 1) пропан 2) циклогексен 3) 2-бромбутан 4) бутен-2-овая кислота 5) 1-бром-3-метилбутан 11. Укажите верное(ые) утверждение(я). При бромировании этилена электрофил: 1) Br– 2) Br+ 3) атакует s- связь 4) атакует p -связь 5) присоединяется к атому водорода 12. Укажите верное(ые) утверждение(я). В реакциях электрофильного присоединения алкенов образование π -комплекса сопровождается: 1) разрушением π -связи 2) взаимодействием электронодефицитной частицы с π -связью 3) переходом атома углерода из sp2 в sp3 гибридное состояние 4) образованием карбокатиона 13. При гидратации бутена-1 в качестве главного продукта образуется: 1) бутанол-1 2) бутанол-2 3) бутандиол-1, 2 4) бутан 5) бутанлиол-2, 3 14. Наибольшую реакционную способность при взаимодействии с HBr проявляет: 1) этилен 2) пропилен 3) 2-метилпропен 4) акролеин 3) 3, 3, 3-трифторпропен 15. Какие утверждения верны? В реакциях электрофильного присоединения алкенов образование σ -комплекса сопровождается: 1) разрушением π -связи 2) образованием σ -связи 3) образованием карбкатиона 4) образованием карбаниона 16. Возрастание реакционной способности молекул в реакциях галогенирования происходит в ряду: 1) пропеновая кислота, 2-метилпропен, пропен 2) пропен, 2-метилпропен, пропеновая кислота 3) пропеновая кислота, пропен, 2-метилпропен 4) 2-метилпропен, пропен, пропеновая кислота 17. Какие утверждения верны? Согласно правилу Марковникова: 1) при присоединении к несимметричному алкену атом водорода реагента присоединяется к наиболее гидрогенизированному атому углерода при двойной связи 2) из двух возможных карбкатионов быстрее образуется карбокатион с наибольшей энергией 3) электрофильное присоединение протекает через стадию образования наиболее стабильного карбкатиона 4) бромирование этилена протекает региоселективно 18. По механизму электрофильного присоединения протекают реакции:
19. Какие реакции протекают против правила Марковникова? 1) гидратация пропена 2) гидратация пропеновой кислоты 3) гидробромирование бутен-2-овой кислоты 4) гидратация циклогексена 5) бромирование этена 20. По механизму электрофильного присоединения протекают реакции:
21. Четыре монохлорпроизводные алкана образуются при хлорировании: 1) 2-метилпропана 2) 2-метилбутана 3) 2-метилпентана 4) 3-метилпентана 5) 3, 3-диметилпентана 22.Укажите молекулы, в которых на стадии образования монозамещенного продукта скорость замещения любого атома водорода на атом галогена одинакова: а) пропан; б) бутан; в) изобутан; г) 2, 2-диметилпропан; д) циклопропан; е) метилциклопропан; ж) циклогексан: 1) а, б, в 2) а, б, д, ж 3) г, д, ж 4) б, г, е 5) а, г, е, ж 23. Только два монохлорпроизводных может образоваться при хлорировании соединений, номера которых:
1) 1, 2, 3 2) 2, 3, 4 3) 4, 5 4) 1, 4 5) 2, 3, 5 24. Укажите названия соединения, которое будет образовываться с наибольшим выходом при бромировании 2-метилбутана:
1) 2-бром-2-метилбутан 2) 2-бром-3-метилбутан 3) 1-бром-2-метилбутан 4) 1-бром-3-метилбутан 5) 2-бром-2-метилпентан 25. Укажите название соединения, которое будет образовываться с наибольшим выходом при бромировании пропилбензола:
1) 1-бром-3-фенилпропан 2) 2-бром-1-фенил–пропан 3) 1-бром-1-фенилпропан 4) 1-бром-2-пропилбензол 5) 1-бром-4-пропилбензол 26. Выберите верные утверждения. В реакции гидрохлорирования пропена:
1) самой медленной стадией реакции является образование p- комплекса 2) самой медленной стадией является образование s-комплекса 3) самой медленной стадией является нуклеофильная атака анионом хлора образующегося карбкатиона 4) самой быстрой стадией является образование s-комплекса 5) реакционная способность пропена в этой реакции выше реакционной способности этена 27. Выберите верные утверждения. В реакции гидратации акриловой кислоты:
1) самой медленной стадией является образование p-комплекса 2) реакционная способность акриловой кислоты выше реакционной способности этена 3) реакционная способность акриловой кислоты ниже реакционной способности этена 4) реакция протекает через образование более стабильного первичного карбкатиона 5) реакция протекает через образование менее стабильного первичного карбкатиона 28. Укажите номера неверных утверждений. В реакции гидробромирования изопрена:
1) образуются два p-комплекса 2) из p-комплексов образуются шесть карбкатионов (s -комплексы) 3) продукты 1.2-присоединения образуются из карбкатионов s1 и s3 4) продукты 1, 2 присоединения образуются из карбкатионов s2 и s4 5) продукты 1, 4-присоединения образуются из карбкатионов s5 и s5
ЗАНЯТИЕ № 5 ТЕМА: Реакционная способность углеводородов. Механизм реакций электрофильного замещения. ЦЕЛЬ: Сформировать умение прогнозировать реакционную способность ароматических соединений в реакциях электрофильного замещения, исходя из электронных эффектов заместителей или гетероатомов, содержащихся в цикле.
ИСХОДНЫЙ УРОВЕНЬ: 1. Типы гибридизации атомных орбиталей (sp3- и sp2-) атома углерода. 2. Сопряжение открытых и замкнутых систем. Ароматичность. 3. Электронные эффекты заместителей. 3. Конформационное строение циклогексана.
Содержание занятия 1. Рассмотрение теоретических вопросов. 1.1 Общая схема механизма реакций электрофильного замещения (SE) в ароматических соединениях. 1.2 Ориентирующее действие заместителей в бензольном ядре (заместители I и II рода). 1.3 Механизм реакций SE на примерах реакций галогенирования, алкилирования, сульфирования, нитрования бензола, толола, фенола, бензойной кислоты. 1.4 Механизм реакций электрофильного замещения в ароматических гетероциклических соединениях на примерах бромирования пиррола и пиридина. 2. Практическая часть. 2.1 Письменный контроль усвоения материала. 2.2 Лабораторная работа.
ЛИТЕРАТУРА: 1. Тюкавкина Н.А., Бауков Ю.И.. Биоорганическая химия. «Медицина», Москва, 1985, С.142-152, 156-158; 1991, С. 135-141, 146-148; 2008, С.135-149. 2. Павловский Н.Д. Лекции по биоорганической химии. Гродно, ГрГМУ, 2011, С. 36-48. 3. Руководство к лабораторным занятиям по биоорганической химии под редакцией Тюкавкиной Н.А., «Медицина», Москва, 1985, С. 68-80. 4. Конспект лекций.
|