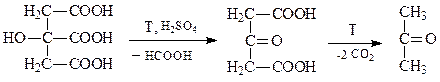Лабораторная работа №3. Разложение лимонной кислоты
Ход работы. В сухую пробирку, снабженную газоотводной трубкой, поместите лопаточку лимонной кислоты и 10 капель концентрированной серной кислоты, полученную смесь нагрейте. Конец газоотводной трубки поместите в первую пробирку с 5 каплями раствора гидроксида бария. После того как раствор помутнеет, перенесите газоотводную трубку во вторую пробирку, содержащую 2 капли раствора йода в йодиде калия, предварительно обесцвеченного добавлением нескольких капель 10% раствора гидроксида натрия. Во второй пробирке наблюдается образование бледно-желтого осадка с характерным запахом. Лимонная кислота, являясь a -гидроксикислотой, при нагревании под действием серной кислоты разлагается с образованием ацетондикарбоновой кислоты, которая далее, подвергаясь декарбоксилированию, превращается в ацетон.
Напишите уравнение реакции, протекающей в первой пробирке между гидроксидом бария и продуктом разложения лимонной кислоты. Напишите схему реакции, протекающей во второй пробирке. В выводе укажите, какие продукты разложения лимонной кислоты обнаружены в обоих случаях.
Вывод: __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Тестовые задания к теме: «Гетерофункциональные органические соединения, участвующие в процессах метаболизма» 1. Полифункциональными соединениями являются: 1) этиленгликоль 2) глицин 3) щавелевая кислота 4) молочная кислота 5) этанол 2. Качественной реакцией на 1, 2-диольный фрагмент является взаимодействие с: 1) AlCl3 2) Cu(OH)2 3) KMnO4 4) CH3COOH 5) Ag2O (NH3× Н2О) 3. Двухатомными фенолами являются:
1) а, в 2) б, г 3) в, д 4) б, д 5) а, д 4. К кетоновым телам относятся следующие соединения: 1) муравьиная кислота 2) щавелевоуксусная кислота 3) ацетон 4) β -гидроксимасляная кислота 5) ацетоуксусная кислота 5. Лактам образуется при нагревании: 1) молочной кислоты 2) глицирина 3) b-аминомасляной кислоты 4) ацетата кальция 5) g- аминомасляной кислоты 6. Лактид образуются при нагревании: 1) a-оксимасляной кислоты 2) молочной кислоты 3) аланина 4) пропанола-2 5) g-оксивалериановой кислоты 7. В каких таутомерных формах молекул содержатся только три атома углерода в sp2-гибридном состоянии? 1) енольная форма пировиноградной кислоты 2) енольная форма щавелевоуксусной кислоты 3) кето-форма ацетоуксусной кислоты 4) енольная форма ацетоуксусной кислоты 5) кето-форма щавелевоуксусной кислоты 8. Кето-енольная таутомерия щавелевоуксусной кислоты обусловлена: 1) переносом протона 2) окислительно-восствновительными реакциями 3) наличием СН-кислотного центра 4) электрофильным присоединением к p -связи 5) наличием ОН-кислотного центра 9. Для каких соединений возможна кето-енольная таутомерия: 1) ацетоуксусная кислота 2) щавелевая кислота 3) щавелевоуксусная кислота 4) ацетон 5) этаналь 10. Доказательством наличия енольной гидроксильной группы служит: 1) взаимодействие енола с металлическим натрием 2) взаимодействие енола с гидроксидом натрия 3) взаимодействие енола с бромной водой 4) взаимодействие енола с воссстановителями 5) взаимодействие енола с хлоридом железа (III) 11. Доказательством наличия двойной связи в енольной форме соединения является: 1) взаимодействие енола с бромной водой 2) взаимодействие енола с водородом 3) взаимодействие енола с галогеноводородами 4) взаимодействие енола с галогенангидридом карбоновой кислоты 5) взаимодействие енола с синильной кислотой 12. В галоформную реакцию вступают: 1) пировиноградная кислота 2) щавелевоуксусная кислота 3) ацетоуксусная кислота 4) a-кетоглутаровая кислота 5) молочная кислота 13. С гидроксидом натрия реагируют: 1) молочная кислота карбоксильной группой 2) молочная кислота гидроксильной группой 3) g-аминомасляная кислота аминогруппой 4) g-аминомасляная кислота карбоксильной группой 5) g-аминомасляная кислота гидроксильной группой 14. Ацетон образуется в результате декарбоксилирования: 1) пировиногрданой кислоты 2) ацетоуксуной кислоты 3) щавелевоуксусной кислоты 4) масляной кислоты 5) щавелевой кислоты 15. Пировиноградная кислота образуется в результате декарбоксилирования: 1) ацетона 2) a-кетоглутаровой кислоты 3) ацетоуксусной кислоты 4) щавелевоуксусной кислоты 5) g-аминомасляной кислоты
занятие № 12 Тема: Биологически активные гетероциклические соединения. Цель: Закрепить знание строения и химических свойств ароматических гетероциклических соединений, составляющих химическую основу некоторых метаболитов и лекарственных веществ.
Исходный уровень: 1. Электронное строение пиррольного и пиридинового атомов азота. 2. Кислотность и основность органических соединений. 3. Ароматичность гетероциклических систем. Критерии ароматичности. 4. Химические свойства гидроксильной, карбоксильной и аминогрупп.
Содержание занятия 1. Разбор теоретического материала. 1.1 Пиразол, строение, ароматичность, амфотерность. Пиразолон-5 – структурная основа лекарственных препаратов. 1.2 Имидазол, строение, ароматичность, амфотерность. Гистидин, гистамин, биологическая роль. 1.3 Бензпиррол (индол). Триптофан, его превращения (образование триптамина, серотнонина, β -индолилуксусной кислоты). Биологическая роль серотонина. 1.4 Пиридин, строение, свойства. Никотиновая кислота, её амид. Химическая основа действия кофермента НАД. 1.5 Пиримидин, строение, свойства. Лечебные препараты, производные изоникотиновой кислоты, тубазид и фтивазид. 1.6 Строение и таутомерия барбитуровой кислоты. Лечебные препараты, производные барбитуровой кислоты (барбитал). 1.7 Пурин. Гидроксилированные производные пурина. Лактам-лактимная таутомерия. Соли мочевой кислоты. Подагра. 1.8 Понятие об алкалоидах. Пуриновые алкалоиды (метилированные производные ксантина). 2. Практическая часть. 2.1 Письменный контроль усвоения материала. 2.2 Лабораторная работа.
ЛИТЕРАТУРА: 1. Тюкавкина Н.А., Бауков Ю.И.. Биоорганическая химия. «Медицина», Москва, 2008, С. 278-281, 287-289, 293-296, 298-302, 306-307, 309-310, 484-485, 487-488; 1991, С. 275 – 283, 286 – 294, 296 – 304, 307. 2. Павловский Н.Д. Лекции по биоорганической химии. Гродно, ГрГМУ, 2011, С.126-137. 3. Руководство к лабораторным занятиям по биоорганической химии под редакцией Тюкавкиной Н.А., «Медицина», Москва, 1985, С.163-179. 4. Конспект лекций.
Практическая часть
|