СРЕДСТВА СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ, ТЕРАПИИ И ДИАГНОСТИКИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 5 страница
Оборудование и материалы. Белые мыши с клиническими признаками ботулизма и столбняка, готовые фиксированные мазки из культур С. tetani, С. botulinum, биопрепараты.
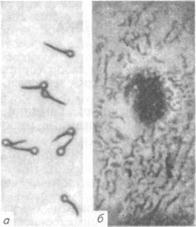
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Столбняк. Острое инфекционное заболевание животных и человека, вызываемое токсином микроба С. tetani. Характеризуется повышенной возбудимостью и судорожными сокращениями мускулатуры тела, приводящими к асфикции, развивается в результате попадания спор возбудителя в раны. К возбудителю восприимчивы все виды домашних животных, особенно чувствительны лошади. Болезнь может возникнуть после родовых травм, кастрации, обрезания хвостов или пуповины у новорожденных, если при этих операциях были нарушены правила асептики и антисептики. Возбудитель столбняка - С. tetani, род Clostridium. Лабораторная диагностика столбняка основана на результатах ^бактериологического исследования. Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методами световой микроскопии и биопробы, выделение чистой культуры и идентификацию возбудителя по культурально-мор-фологическим, биохимическим и токсигенным свойствам. Материал для исследования. Клиническая картина столбняка характерна, поэтому материал направляют для лабораторного исследования в сомнительных случаях. Им служит раневой экссудат, кусочки ткани из глубоких слоев мест поражения. Микроскопия препаратов из исходного материала. С. tetani — Выделение и идентификация культуры возбудителя. С. tetani — строгий анаэроб, температурный оптимум 37 º С, рН 7, 4...7, 9. Исследование проводят с целью обнаружения токсина и выделения культуры возбудителя для последующего определения ее токсигенности. Чтобы выделить чистую культуру, материал высевают на среду Китта-Тароцци, содержащую 0, 5 % глюкозы. Половину посевов (пробирки) прогревают при 80 °С в течение 1 ч. Через 24 ч на среде Китта-Тароцци возбудитель дает интенсивное помутнение среды с незначительным газообразованием. Через 48...72ч наступает просветление среды, а на дне пробирки образуется осадок. Для культуры характерен запах жженого рога (вследствие протеолиза белков). Через 4...5 сут у полученной культуры определяют токсигенные свойства. При необходимости первичные посевы, содержащие типичные клетки возбудителя, прогревают при 80 º С 20 мин и делают дробный посев на_глкжозо-кровяной агар в чашках Петри. На кровяном агаре С. tetani образует нежные колонии с отростками и приподнятым центром, иногда мелкие круглые колонии. Некоторые колонии окружены зоной гемолиза (рис. 92).
Рис. 92. С. tetani: а — чистая культура; б — колония У чистых культур возбудителя исследуют биохимические свойства. С. tetani гидролизует желатину, не образует индол, лецити-назу, расщепляет до кислоты глюкозу, мальтозу, фруктозу, свертывает молоко, образует сероводород. Биопроба. Метод применяют для обнаружения токсина в исследуемом материале, а также для подтверждения токсигенных свойств выделенной культуры возбудителя. Для обнаружения токсина исследуемый материал растирают в физиологическом растворе, экстрагируют при комнатной температуре 1 ч, фильтруют. Фильтрат вбодят подкожно в заднюю лапку' двум-трем белым мышам по 0, 5...1 мл или двум морским свинкам по З...5мл. При наличии токсина через 48...96ч у животных развивается те-таническое сокращение мышц отдельных групп, а затем всей мускулатуры. Животное погибает в позе с вытянутыми лапками и искривлением позвоночника в сторону лапки, в которую вводили материал. При наличии токсина исследования по выделению культуры возбудителя прекращают. Ботулизм. Это остро текущий кормовой токсикоз, возникающий вследствие поедания кормов, содержащих токсин возбудителя. Заболевание проявляется параличом мышц глотки, языка, нижней челюсти и скелетных мышц. К ботулизму восприимчивы многие виды животных, в том числе птицы, а также люди. Из лабораторных животных — белые мыши и морские свинки. Возбудитель ботулизма — С. botulinum. Лабораторная диагностика ботулизма основана на результатах бактериологического исследования. Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии и его токсина методом биопробы, выделение чистой культуры и идентификацию возбудителя по культурально-морфологическим, ферментативным и токсиген-ным свойствам. Материал для исследования. В лабораторию направляют пробы корма, вызвавшего отравление; от павших животных - содержимое желудка, кишечника, кусочки печени, селезенки; от больных животных — кровь. Материал берут в течение двух часов после гибели животного. Нативный материал исследуют одновременно на наличие токсинов и возбудителя. Кровь исследуют только на токсин и быстро, на месте, так как токсин в крови быстро разрушается. Микроскопия препаратов из исходного материала. В препаратах из материала, окрашенных по Граму, С. botulinum обнаруживают в форме прямой или слегка изогнутой с закругленными концами грамположительной палочки размером (0, 6...1, 4) х (4...9) мкм. Споры овальные, больше диаметра клетки, располагаются терминально или субтерминально, придавая клетке вид «теннисной ракетки». Возбудитель образует жгутики, не формирует капсулу. Выделение и идентификация культуры возбудителя. Основное направление при лабораторной диагностике ботулизма — обнаружение ботулинического токсина. Выделение чистой культуры с испытанием ее токсигенных свойств проводят только при отрицательных результатах исследований на наличие токсина в материале.
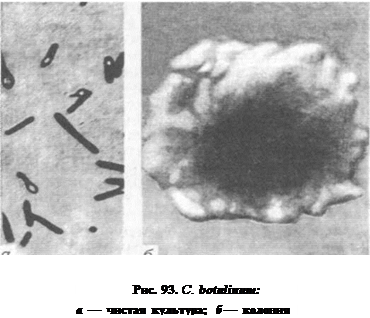
С. botulinum — строгий анаэроб, температурный оптимум 30...35 °С, рН 7, 2...7, 4. Чтобы выделить культуру возбудителя, исследуемый материал высевают в два флакона со средой Китта-Тароцци, один из них прогревают при 80 °С 1 ч, затем оба флакона инкубируют. Рост возбудителя характеризуется постепенным помутнением среды (на 2...3-й сутки), газообразованием. У культуры отмечают специфический запах прогорклого масла. В культуре обнаруживают типичные для возбудителя клетки бактерий. На 5...7-е сутки инкубирования испытывают токсигенные свойства культуры (см. биопробу). Для выделения чистой культуры возбудителя первичные посевы прогревают при 80 º С 1 ч и дробно рассевают на глюкозо-кровяной агар в чашках Петри. Посевы инкубируют в анаэростате. Через 4...5 сут просматривают посевы. Колонии С. botulinum круглые, с корневидными отростками, бесцветные или сероватые с зоной бета-гемолиза (рис. 93). У выделенных культур определяют ферментативные свойства. Возбудитель медленно разжижает желатину, пентонизирует молоко, ферментирует до кислоты и газа глюкозу, мальтозу, салицин, глицерин, адонит. Биопроба. Метод применяют ддя обнаружения токсина в исследуемом материале или для определения токсигенных свойств выделенной культуры возбудителя. С. botulinum продуцирует токсины семи типов: А, В, С, D, Е, F, G. Все семь сероваров экзотоксина иммунологически специфичны, что выявляют в реакции нейтрализации. Для обнаружения токсина исследуемый материал (20...30 г) растирают в физиологическом растворе (в соотношении 1: 2), экстрагируют при комнатной температуре 2 ч, фильтруют через вату и делят на две части, одну часть прогревают при 100 º С 20...30 мин. Затем нативным и прогретым фильтратом заражают внутривенно или внутрибрюшинно двух белых мышей. Морских свинок заражают подкожно по 3...5 мл. При наличии ботулини-ческого токсина животные, которым введен кипяченый фильтрат, остаются живыми, нативный — погибают на 2...5-е сутки с характерной клиникой ботулизма: шаткая походка, учащенное дыхание, расслабление скелетной мускулатуры, западание брюшной стенки («осиная талия»). При обнаружении в исследуемом материале токсина проводят его идентификацию. Для этого смешивают по 0, 2 мл различных антисывороток в одной пробирке (А, В, С, D, Е), добавляют 1 мл экстракта, выдерживают 45 мин при 35...37 °С и вводят внутрибрюшинно двум белым мышам. Контрольным животным вводят смесь фильтрата с физиологическим раствором. При выживании мышей, зараженных смесью фильтрата и сыворотки, и при гибели контрольных токсин идентифицируют как ботулинический. Этот результат служит достаточным основанием для постановки положительного диагноза на ботулизм. При необходимости определяют тип токсина в РН: смешивают по 2, 4 мл фильтрата и 0, 6 мл типовых сывороток, выдерживают в термостате и ставят биопробу на мышах, как было описано выше. Биопрепараты. Столбнячный анатоксин представляет собой фильтрат токсинсодержащей бульонной культуры, инактивированной формалином при 39...40°С в течение 25...30 сут. Затем к фильтрату добавляют алюмокалиевые квасцы, концентрируют удалением 80 % надосадочной жидкости и контролируют готовый препарат на стерильность, безвредность и активность иммунизацией морских свинок с последующим заражением 200 ДЛМ токсина. Вакцину против ботулизма норок готовят из С. botulinum типа С. Бульонную токсинсодержащую культуру инактивируют формалином при 37 º С в течение 35 сут. В каждой серии вакцины количество анатоксина варьирует, что не позволяет рекомендовать для вакцинации животных одну постоянную дозу вакцины. Поэтому в опыте вакцинации с последующим прямым заражением на мышах рассчитывают ЕД50 препарата (по методу Кербера) и, исходя из полученных данных, определяют рабочую дозу вакцины. Ботулинические диагностические антитоксические сыворотки предназначены для идентификации ботулинических токсинов в реакции нейтрализации.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Окрасить по Граму мазки из культур возбудителей столбняка и ботулизма, зарисовать микроскопическую картину. 2. Изучить клиническую картину столбняка и ботулизма (лабораторные животные). 3. Проанализировать схемы лабораторной диагностики столбняка и ботулизма. 4. Ознакомиться с биопрепаратами. Контрольные вопросы 1. Каковы морфологические и культуральные признаки возбудителя столбняка? 2. Каковы особенности бактериологического исследования при столбняке? 3. Какой материал направляют в лабораторию для диагностического исследования при ботулизме? 4. Как определяют тип токсина С. botulinum?
Тема 28 ЛАБОРАТОРНАЯ ДИАГНОСТИКА НЕКРОБАКТЕРИОЗА И КОПЫТНОЙ ГНИЛИ. БИОПРЕПАРАТЫ Цель занятий. Ознакомить студентов со свойствами возбудителей и особенностями лабораторной диагностики некробактериоза, копытной гнили и биопрепаратами. Оборудование и материалы. Культура F. necrophorum на среде Китта-Тароцци, кровяном (сывороточном) МПА, мазки из культур (патматериала) В. nodosus, биопрепараты.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Некробактериоз. Инфекционное заболевание, характеризующееся гнойно-некротическим поражением кожи и подлежащих тканей, слизистых оболочек и паренхиматозных органов. К некробактериозу восприимчивы все виды сельскохозяйственных животных, а также человек. Наиболее чувствителен молодняк. Возбудитель некробактериоза — Fusobactehum necrophorum, род Fusobacterium, семейство Bacteroidaceae. Лабораторная диагностика некробактериоза основана на результатах бактериологического исследования. Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методами световой микроскопии и биопробы, выделение чистой культуры и идентификацию возбудителя по культурально-морфологическим, ферментативным и патогенным свойствам. Материал для исследования. В лабораторию направляют трупы мелких животных целиком, от крупных животных — пораженные ткани и кусочки паренхиматозных органов с очагами некроза. Для прижизненной диагностики берут соскобы с участков поражения на границе здоровой и некротизированной ткани. Микроскопия препаратов из исходного материала. Возбудитель — грамотрицательная, полиморфная бактерия, образующая длинные нити, неподвижная, без спор и капсул. Хорошо окрашивается фуксином Циля, синью Леффлера, а также по методу Муромцева и Романовского—Гимзы. В мазках-отпечатках из пораженного органа возбудитель обнаруживают в виде грамотрицательных, длинных, иногда, переплетающихся, неравномерно окрашенных нитей (рис. 94).
Выделение и идентификация культуры возбудителя. F. necrophorum — облигатный анаэроб и может расти на обычных для анаэробов средах (среда Китта-Тароцци, бульон Мартена, печеночный бульон Хоттинге-ра, мозговая среда, сывороточный и глюкозо-кровяной агар), при 37...38 °С, рН 7, 4...7, 6. ИсСЛедуемыЙ материал высевают на среду Китта-Тароцци, МПА В МПБ. На среде Китта-Тароцци возбудитель через 24...48 ч вызывает интенсивное помутнение сначала нижнего слоя, а позднее и всей среды. Газообразование очень слабое, отмечают в первые часы роста. Через 5...8 сут наблюдают просветление бульона с выпадением порошковидного осадка. При высеве на плотные среды рост появляется через 48...72 ч в виде мелких росинок диаметром около 1 мм, через 4...5 сут колонии увеличиваются в размере, становятся хорошо заметными невооруженным глазом, окрашены в серовато-белый или зеленоватый цвет, края колоний ровные или немного зазубренные. На глюкозном агаре с эритроцитами кролика некоторые штаммы образуют зону альфа- или бета-гемолиза. В столбике с сывороточным агаром на четвертые-пятые сутки вырастают че-чевицеобразные колонии с нитевидными отростками. В связи с тем что получение чистой культуры на питательных средах затруднительно, ее целесообразно выделять методом биопробы. У выделенных культур изучают ферментативную активность. Возбудитель образует индол, сероводород, разлагает с образованием кислоты и незначительного количества газа глюкозу, сахарозу, мальтозу, слабо ферментирует лактозу, не разжижает желатину и свернутую сыворотку, не редуцирует нитраты. Биопроба. Одновременно с посевами заражают кролика суспензией из исследуемого материала с физиологическим раствором, которую вводят в объеме 0, 5... 1 мл под кожу средней трети наружной поверхности уха. Для заражения можно использовать суточную бульонную культуру возбудителя в тех же объемах. Наблюдение за зараженными животными ведут в течение 10 дней. При наличии в исследуемом материале F. necrophorum у кролика через З...4дня на месте инъекции развивается некроз. Из очага некроза делают мазки и окрашивают одним из методов. Пробу считают положительной при обнаружении в мазках зернистоок-рашенных грамотрицательных нитей возбудителя некробактериоза. Биопрепараты. «Нековак» — ассоциированная вакцина против некробактериоза конечностей крупного рогатого скота. Двухкомпонентная вакцина «Нековак» с иммуностимулятором ГМДП (глюкозаминилмурамилпептид). Копытная гниль. Это хроническое инфекционное заболевание овец и коз. Характеризуется воспалением кожи межкопытной щели, отслоением и гнилостным распадом роговой ткани копытца вплоть до полного отхождения рогового башмака. Возбудитель копытной гнили — Bacteroides nodosus, род Bacteroides, семейство Bacteroidaceae. Лабораторная диагностика копытной гнили основана на результатах бактериологического исследования. Бактериологическое исследование включает в себя световую, люминесцентную микроскопию и биологическую пробу. Материал для исследования. В лабораторию направляют мазки-отпечатки из свежеприготовленных тканей, мазки из слизи и слизь с кожи межкопытной щели, кусочки тканей с границы здоровых и пораженных участков, пораженные копыта от вынужденно убитых животных. Материал исследуют от нелеченых и не подвергавшихся обработке дезинфицирующими препаратами животных. Микроскопия препаратов из исходного материала. Возбудитель копытной гнили представляет собой грамотрицательную палочку размером (l...l, 7) х 3, 6мкм, неподвижную, без спор и капсул. Мазки-отпечатки из нативного материала и доставленные мазки для исследования окрашивают по Граму и микроскопи-руют. В. nodosus обнаруживают в виде грамотрицательных, прямых или слегка изогнутых крупных палочек, иногда с утолщениями на одном или обоих концах. Располагаются поодиночке или парами. В мазках из нативного материала могут быть окружены радиально отходящими от них мелкими грамотрицательными палочками (феномен Бевериджа). Для обнаружения возбудителя в материале используют непрямой метод иммунофлуоресценции. Биопроба. Метод применяют при получении сомнительных результатов микроскопических исследований. В опыт берут овец из благополучных по копытной гнили хозяйств, которых для мацерации копыт в течение 10 дней до постановки пробы содержат на влажной подстилке. Двум овцам скарифицируют кожу межкопытных щелей (делают 10....15 надрезов эпидермиса до появления лимфы) двух конечностей — передних и задних и втирают в поврежденный участок исследуемый материал или его суспензию на физиологическом растворе. В межкопытные щели дополнительно вставляют тампоны из обезжиренной шерсти, пропитанные этой же суспензией. Через 4 дня в положительных случаях обнаруживают признаки болезни. Наблюдение за животными ведут в течение 15 дней. От заболевших животных берут материал, делают мазки-отпечатки для световой и люминесцентной микроскопии. При положительном результате биопробы в мазках обнаруживают возбудитель копытной гнили. Биопрепараты. Вакцина против копытной гнили овец инактивированная, эмульгированная.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Приготовить мазки из культур F. necrophorum, окрасить по 2. Изучить культуральные свойства F. necrophorum. 3. Промикроскопировать препараты, содержащие В. nodosus. 4. Ознакомиться с биопрепаратами. Контрольные вопросы 1. Какие среды используют для культивирования возбудителя некробактериоза? 2. Каковы морфологические особенности возбудителя некробактериоза? 3. Как ставят биопробу при диагностике копытной гнили? 4. Как ставят реакцию иммунофлуоресценции при диагностике копытной гнили?
Тема 29 ЛАБОРАТОРНАЯ ДИАГНОСТИКА ЭШЕРИХИОЗОВ (КОЛИ-ИНФЕКЦИИ). БИОПРЕПАРАТЫ Цель занятия. Ознакомить студентов с методами лабораторной диагностики и биологическими свойствами возбудителей эшерихиозов. Оборудование и материалы. Культуры Е. coli на МПА, средах Эндо, Левина, Симмонса, пластины ПБДЭ с результатами тестирования ферментативной активности Е. coli, пробирки цветного ряда с культурой Е. coli (лактоза, глюкоза, индол, среда с мочевиной), наборы агглютинирующих антиадгезивных и О-коли-сывороток, биопрепараты.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Эшерихиоз (колибактериоз). Острая инфекционная болезнь. Проявляется профузным поносом, признаками тяжелой интоксикации и обезвоживанием организма. Болеет молодняк сельскохозяйственных животных многих видов, включая птиц. Эшерихиоз может протекать в энтеритной, септической и энтеротоксемической формах. Возбудители колибактериоза (эшерихиоза) — патогенные варианты бактерии. Е. coli, род Escherichia, семейство Enterobacteriaceae. При энтеритной форме болезни возбудитель локализуется, в кишечнике и регионарных брыжеечных лимфоузлах; при септической форме — в крови, внутренних органах и тканях; при энте-ротоксемической — в тонком отделе кишечника и брыжеечных лимфоузлах. Считают, что ведущая роль в развитии эшерихиоза принадлежит кишечным палочкам, адгезивные антигены которых (К 88, К 99, F 41, 987 Р, А 20 и др.) обеспечивают прикрепление бактерий к эпителиальным клеткам тонкого отдела кишечника с последующим их размножением в клетках, продуцированием энтеротоксинов и проникновением сначала в регионарные лимфоузлы, а затем в кровь. Эшерихии в своем составе содержат 164 варианта О-антигена, 55 вариантов Н-антигена и 90 вариантов К-антигена. О-Антиген (соматический) термостабильный, состоит из полисахаридно-липидно-протеинового комплекса, который определяет серогрупповую принадлежность бактерий (известно свыше 160 серологических групп эшерихий). К-Антиген (поверхностный) подразделяют на три вида, которые обозначают латинскими буквами L, В и A. L- и В-антигены термолабильные, разрушаются при 100 º С в течение 1 ч. А-антиген (капсуальный) термостабильный, разрушается при автоклавирова-нии (121 °С) в течение двух часов, обнаружен у бактерий некоторых серологических групп (08, 09, 0101 и др.). Поверхностные (L, В, А) антигены препятствуют агглютинации бактерий соответствующей агглютинирующей О-сывороткой, поэтому при серогрупповой типизации культур эшерихий их подвергают термической обработке: прогреванию в водяной бане или автоклавированию. Н-Антиген (жгутиковый) термолабильный, белковой природы, обнаружен у подвижных штаммов эшерихий. Сочетание О-, К- и Н-антигенов характеризует серологический вариант (серовар) бактерий. Эпизоотические вспышки колибактериоза наиболее часто вызывают патогенные штаммы эшерихий следующих серогрупп: у телят - 08, 09, 015, 020, 026, 035, 078, 086, 0101, 0115, 0117, 0119, 0141, реже 02, 033, 041, 055, 0103, 0127, 0137; у поросят - 06, 026, 033, 0101, 0136, 0139, 0141, 0142, 0149, 0152, 0157; у ягнят - 04, 08, 09, 015, 020, 028, 035, 041, 078, 0101, 0137; у птиц -01, 02, 08, 015, 018, 026, 055, 078, 0111, 0113, 0128, 0141. У поросят-отъемышей энтеротоксемическая форма колибактериоза называется отечной болезнью. Клинические признаки колибактериоза: слабость, потеря аппетита, угнетенное состояние животных, обезвоживание организма вследствие диареи. При затяжном течении наблюдают также серозно-гнойные выделения из носовых отверстий, артриты. Отечная болезнь у поросят-отъемышей характеризуется появлением отеков век, носовой части головы, подчелюстной области. Нарушается координация движений, отмечают судороги, парезы, гиперемию кожи ушей, пятачка, живота. Иногда наблюдают кратковременное повышение температуры тела в начале болезни. Лабораторная диагностика эшерихиоза основана на результатах бактериологического исследования. Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры, идентификацию возбудителя на уровне вида и определение его принадлежности к группе патогенных вариантов. Материал для исследования. Для прижизненной бактериологической диагностики колибактериоза в лабораторию направляют фекалии больных животных (не менее чем от 5 животных с одной фермы), не подвергавшихся лечению антибактериальными препаратами. Пробы фекалий массой 1...2 г от каждого животного берут из прямой кишки в стерильные пробирки с помощью прокипяченного резинового катетера. Микроскопия мазков из исходного материала. Мазки-отпечатки окрашивают по Граму. Е. coli — палочковидная грамотрицательная бактерия размером (0, 3... 1) х (1...6) мкм со жгутиками (за редким исключением), спор и капсул не образует. Микробные клетки располагаются одиночно, парно или в виде коротких цепочек. Выделение и идентификация культуры возбудителя. Е. coli — факультативный анаэроб, температурный оптимум 37...38 º С, рН 7, 2...7, 4, к питательным средам нетребователен. Посевы из паренхиматозных органов, костного и головного мозга, брыжеечных лимфоузлов и тканей животных делают на среду Эндо или Левина методом отпечатков или наносят материал на поверхность среды пастеровской пипеткой и равномерно растирают шпателем. Пробы фекалий (не более 0, 5 г) или соскобы со слизистой оболочки кишечника от каждого животного помещают в отдельную стерильную пробирку, затем разводят в 10 мл стерильного физиологического раствора, тщательно перемешивают и выдерживают 10...15 мин при комнатной температуре для осаждения крупных частиц. Надосадочную жидкость засевают бактериологической петлей в чашки со средой Эндо или Левина для получения изолированных колоний. На второй день просматривают чашки и отбирают 10 колоний, выросших при посеве фекалий, и 5 колоний, выросших при посеве тканевых органов, характерных для эшерихий: круглых, с ровными краями, с гладкой выпуклой поверхностью, размером 2...4 мм, малинового цвета — на среде Эндо и темно-фиолетового — на среде Левина. Иногда у колоний отмечают металлический блеск. Колонии пересевают на МПА и среду Минка. При поддержании на обычных средах эшерихий быстро утрачивают адгезивные факторы, при культивировании на среде Минка — сохраняют. В состав указанной среды входят буфер (рН 7, 5), соли магния, марганца, хлорид железа, хлорид кальция, гидролизат лактальбумина, глюкоза, агар. При подозрении на отечную болезнь поросят дополнительно делают высев на кровяной МПА, поскольку штаммы, вызывающие эту патологию, обычно синтезируют бета-гемолизин. На МПА Е. coli образует круглые, выпуклые, с гладкой поверхностью и ровными краями колонии (S-форма) (рис. 95), возможно появление R-форм. Из культур, выросших на МПА и среде Минка, делают мазки и окрашивают по Граму.
Рис. 95. E. coli: а – чистая культура; б - колония
При обнаружении бактерий, типичных по морфологическим, тинкториальным и культуральным свойствам для Е. coli биохимические свойства не изучают, а сразу исследуют в РА на стекле с агглютинирующими антиадгезивными сыворотками, вначале с комплексной, а затем при получении положительного результата с моновалентными сыворотками. Результат реакции учитывают в течение одной минуты. Контролем служат: 1) исследуемая культура + физиологический раствор; 2) культура + нормальная кроличья сыворотка, разведенная в соотношении 1: 10. Культуры, выросшие на МПА, проверяют с сыворотками К 88, 987 Р и А 20, культуры со среды Минка —с сыворотками К 99 и F41. При положительной РА культуры относят к возбудителям эшерихиоза и на этом заканчивают их дальнейшее изучение. При отсутствии эшерихий с адгезивными антигенами культуру идентифицируют на основании изучения ферментативных признаков. Для Е. coli характерно расщепление глюкозы и лактозы с образованием кислоты и газа, выделение индола, отсутствие уреазы и неспособность утилизировать цитраты. У культур, идентифицированных как Е. coli, устанавливают О-серогрупповую принадлежность как косвенный показатель патогенности или изучают патогенность в биопробе на белых мышах, цыплятах. О-Серогруппу эшерихий устанавливают следующим образом. Культуры, выращенные на скошенном МПА при 37 °С в течение 18...20 ч, смывают физиологическим раствором, переносят в сухие стерильные пробирки, прогревают в водяной бане при 100 º С 1 ч для разрушения поверхностных термолабильных L- и В-анти-генов или автоклавируют при 120 º С 2 ч для разрушения термостабильного А-антигена. Прогретую взвесь бактерий центрифугируют при 2000...3000 мин-1 10...15 мин и осадок используют в качестве антигена для постановки РА на стекле. Оставшуюся часть антигена разводят стерильным физиологическим раствором до концентрации клеток 5*103/мл и ставят пробирочную РА. Определение серогрупповой принадлежности культур начинают с постановки РА на стекле с групповыми поливалентными сыворотками: на чистое обезжиренное стекло наносят по капле поливалентные сыворотки. В каждую каплю петлей вносят осажденную центрифугированием культуру, и хорошо смешивают, результат учитывают в течение 3 мин. Положительная реакция характеризуется образованием мелкозернистого агглютината и просветлением жидкости. При отрицательном результате вся капля остается мутной. Антиген, агглютинирующийся одной из поливалентных групповых сывороток, исследуют в РА на стекле с моновалентными сыворотками, разведенными в соотношении 1: 10 и входящими в состав данной поливалентной сыворотки. Затем с моновалентной сывороткой, давшей положительную реакцию, ставят РА в пробирках в объеме 1 мл. Сыворотку разводят физиологическим раствором 1: 25 до титра, указанного на этикетке: сначала готовят исходное разведение — к 2, 4 мл физиологического раствора добавляют 0, 1 мл сыворотки, в остальные пробирки разливают по 0, 5 мл физиологического раствора, из исходного разведения переносят 0, 5 мл смеси во вторую, перемешивают, из второй — в третью и т.д., из последней пробирки удаляют 0, 5мл смеси, из первой — 1, 5 мл. Во все пробирки добавляют по 0, 5 мл антигена. Одновременно ставят контроли: 1) антиген + физиологический раствор (для исключения самоагглютинации); 2) сыворотка, разведенная 1: 25 без антигена (для исключения флокуляции). Все пробирки встряхивают, выдерживают в термостате при 37 °С 16... 18 ч и затем при комнатной температуре — 6...8 ч. Читают реакцию при помощи агглютиноскопа. Результаты учитывают по общепринятому методу и обозначают в крестах (++++, +++, ++, +, —).
|